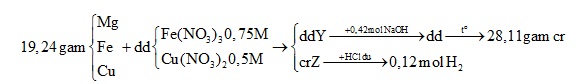Trắc nghiệm Tổng hợp bài tập kim loại tác dụng với dung dịch muối hay và khó - Hóa 12Đề bài Câu 1 : Hòa tan hoàn toàn a gam hỗn hợp gồm x mol AgNO3 và y mol Cu(NO3)2 vào nước, thu được dung dịch X. Cho một lượng Cu dư vào X thu được dd Y có chứa b gam muối. Cho một lượng Fe dư vào Y, thu được dung dịch Z có chứa c gam muối. Biết các phản ứng xảy ra hoàn toàn 2b = a + c. Tỉ lệ x : y là:
Câu 2 : Cho m gam Zn vào dung dịch chứa 0,1 mol AgNO3 và 0,15 mol Cu(NO3)2, sau một thời gian thu được 26,9 gam chất rắn và dung dịch X chứa 2 muối. Tách lấy chất rắn, thêm tiếp 5,6 gam bột sắt vào dung dịch X, sau khi các phản ứng xảy ra hoàn toàn thu được 6 gam chất rắn. Giá trị của m là
Câu 3 : Cho hỗn hợp gồm Mg (7a mol) và Fe (4a mol) vào dung dịch chứa 0,08 mol FeCl3 và 0,16 mol CuCl2, sau một thời gian thu được dung dịch X và 7,36 gam chất rắn Y. Cho dung dịch AgNO3 dư vào X, kết thúc phản ứng thu được 84,68 gam kết tủa. Nếu cho NaOH dư vào X (không có mặt oxi) thu được 24,72 gam các hiđroxit kim loại. Lấy 7,36 gam Y hòa tan trong dung dịch HNO3 loãng dư thu được 0,08 mol khí NO duy nhất và dung dịch T chứa m gam muối. Giá trị của m là
Câu 4 : Hỗn hợp X gồm Mg, Al, Zn. Cho 6,5 gam hỗn hợp X vào 200 ml dung dịch Ba(OH)2 0,5M và KOH 1M, kết thúc phản ứng thu được 4,256 lít khí H2 (đktc). Nếu cho 13 gam hỗn hợp X tác dụng với một lượng dung dịch H2SO4 loãng đến khi ngừng thoát khí thu được 4,032 lít H2 (đktc) và chất rắn không tan Y. Cho Y vào 200 ml dung dịch chứa AgNO3 1M và Cu(NO3)2 2M, sau khi phản ứng xảy ra hoàn toàn thu được 34,4 gam chất rắn X. Thành phần phần trăm số mol của Zn trong X là
Câu 5 : Cho hỗn hợp Mg và Cu tác dụng với 200 ml dung dịch chứa hỗn hợp 2 muối AgNO3 0,3M và Cu(NO3)2 0,25M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch A và chất rắn B. Cho A tác dụng với dung dịch NaOH dư, lọc kết tủa đem nung đến khối lượng không đổi được 3,6 gam hỗn hợp X gồm 2 oxit. Hòa tan hoàn toàn B trong dung dịch H2SO4 đặc nóng thu được 2,016 lít SO2 (đktc). Phần trăm khối lượng Mg trong hỗn hợp đầu là
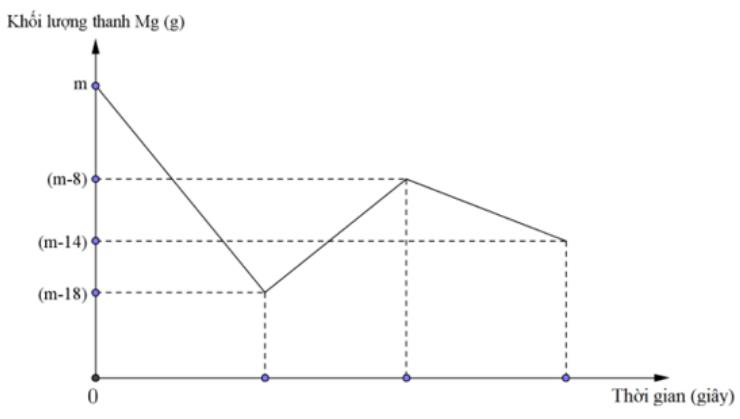
Câu 6 : Khi nhúng thanh Mg có khối lượng m gam vào dung dịch hỗn hợp X chứa a mol Cu(NO3)2 và b mol HCl ta có đồ thị biểu diễn sự phụ thuộc của khối lượng Mg vào thời gian phản ứng được biểu diễn như hình vẽ dưới đây: Sau khi phản ứng xảy ra hoàn toàn, rút thanh Mg ra, thu được NO là sản phẩm khử duy nhất của N+5. Tỉ lệ a : b là
Câu 7 : Cho 19,24 gam hỗn hợp gồm Mg, Fe, Cu vào dung dịch chứa Fe(NO3)3 0,75M và Cu(NO3)2 0,5M. Sau khi kết thúc phản ứng thu được dung dịch Y có chứa 2 muối và 20,56 gam chất rắn Z. Cho 350 ml dung dịch NaOH 1,2M vào dung dịch Y, lọc bỏ kết tủa, cô cạn dung dịch nước lọc, lấy phần rắn đem nung đến khối lượng không đổi thu được 28,11 gam chất rắn khan. Cho dung dịch HCl dư vào rắn Z thấy thoát ra 2,688 lít khí H2 (đktc). Phần trăm khối lượng của Mg có trong hỗn hợp X gần nhất với
Câu 8 : Nung m gam hỗn hợp X gồm bột Al và Fe3O4 sau một thời gian thu được chất rắn Y. Để hòa tan hết Y cần V ml dung dịch H2SO4 0,7M (loãng). Sau phản ứng thu được dung dịch Z và 9,846 lít khí (đo ở 1,5atm; 270C). Cho dung dịch NaOH vào dung dịch Z đến dư, thu được kết tủa M. Nung M trong chân không đến khối lượng không đổi thu được 44 gam chất rắn T.
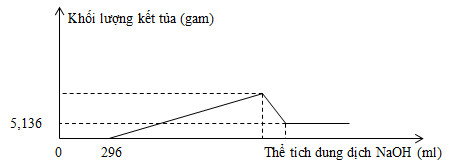
Câu 9 : Thực hiện phản ứng nhiệt nhôm hỗn hợp Al, Fe2O3, Cr2O3 sau một thời gian thu được hỗn hợp chất rắn X. Chia X thành 2 phần bằng nhau. Hòa tan hoàn toàn phần 1 trong dung dịch H2SO4 đặc, nóng, dư, sau khi các phản ứng xảy ra hoàn toàn, thu được 2,016 lít khí SO2 (sản phẩm khử duy nhất, đktc). Hòa tan hết phần 2 trong 400 ml dung dịch HNO3 2M, thu được dung dịch Y và khí NO (sản phẩm khử duy nhất của N+5). Cho từ từ dung dịch NaOH 1M đến dư vào Y thu được kết quả như hình vẽ sau:
Khối lượng Cr2O3 trong hỗn hợp ban đầu là
Câu 10 : Điện phân 600 ml dung dịch X chứa đồng thời NaCl 0,5M và CuSO4 a mol/l (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước) đến khi thu được dung dịch Y có khối lượng giảm 24,25 gam so với khối lượng dung dịch X ban đầu thì ngừng điện phân. Nhúng một thanh sắt nặng 150 gam vào dung dịch Y đến khi các phản ứng xảy ra hoàn toàn, lấy thanh kim loại ra, rửa sạch, làm khô cân được 150,4 gam(giả thiết toàn bộ lượng kim loại tạo thành đều bám hết vào thanh sắt và không có sản phẩm khử của S+6 sinh ra). giá trị của a là
Câu 11 : Cho 9,2 gam hỗn hợp X gồm Mg và Fe cho vào dung dịch AgNO3 và Cu(NO3)2 được chất rắn Y gồm 3 kim loại và dung dịch . Hòa tan hết Y bằng dung dịch H2SO4 đặc nóng thu được 6,384 lít SO2 (đktc) – sản phầm khử duy nhất. Cho NaOH dư vào Z thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi thu được 8,4 gam hỗn hợp rắn khan. Các phản ứng xảy ra hoàn toàn . % khối lượng Fe ban đầu là
Câu 12 : Cho 11,04 gam hỗn hợp X gồm Mg và Fe vào 150 ml dung dịch chứa AgNO3 a mol/lít và Cu(NO3)2 2a mol/lít, khi phản ứng kết thúc thu được chất rắn Y và dung dịch Z. Hòa tan hoàn toàn Y bằng dung dịch H2SO4 đặc nóng dư thu được 7,56 lít khí SO2 (đktc) (sản phẩm khử duy nhất). Cho Z tác dụng với NaOH dư, thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi thu được 10,8 gam hỗn hợp rắn E. Giá trị của a là:
Câu 13 : Cho 4,58 gam hỗn hợp A gồm Zn, Fe và Cu vào cốc đựng 85 ml dung dịch CuSO4 1M. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch B và kết tủa C. Nung C trong không khí đến khối lượng không đổi được 6 gam chất rắn D. Thêm dung dịch NaOH dư vào dung dịch B, lọc kết tủa thu được, rửa sạch rồi nung ở nhiệt độ cao đến khối lượng không đổi thu được 5,2 gam chất rắn E. Các phản ứng xảy ra hoàn toàn. % khối lượng mỗi kim loại trong hỗn hợp A (theo thứ tự Zn, Fe, Cu) là:
Lời giải và đáp án Câu 1 : Hòa tan hoàn toàn a gam hỗn hợp gồm x mol AgNO3 và y mol Cu(NO3)2 vào nước, thu được dung dịch X. Cho một lượng Cu dư vào X thu được dd Y có chứa b gam muối. Cho một lượng Fe dư vào Y, thu được dung dịch Z có chứa c gam muối. Biết các phản ứng xảy ra hoàn toàn 2b = a + c. Tỉ lệ x : y là:
Đáp án : D Phương pháp giải : Bảo toàn khối lượng +) sự chênh lệch khối lượng muối là do kim loại Cu thay thế Ag; Fe thay thế Cu còn NO3- bảo toàn Lời giải chi tiết : AgNO3 : x (mol) Cu(NO3)2 : y (mol) Dd Y : Cu(NO3)2 : 0,5x + y (mol) Dd Z : Fe(NO3)2 : 0,5x + y (mol) Vì sự chênh lệch khối lượng muối là do kim loại Cu thay thế Ag; Fe thay thế Cu còn NO3- bảo toàn nên : 2b = a + c =>2.(0,5. x + y). 64 = 108x + 64y + (0,5x + y).56 => 72x = 8y => 9x = y => x : y = 1: 9 Câu 2 : Cho m gam Zn vào dung dịch chứa 0,1 mol AgNO3 và 0,15 mol Cu(NO3)2, sau một thời gian thu được 26,9 gam chất rắn và dung dịch X chứa 2 muối. Tách lấy chất rắn, thêm tiếp 5,6 gam bột sắt vào dung dịch X, sau khi các phản ứng xảy ra hoàn toàn thu được 6 gam chất rắn. Giá trị của m là
Đáp án : D Phương pháp giải : Sử dụng phương pháp tăng giảm khối lượng. +) Dung dịch X chứa 2 muối nên \(AgN{{O}_{3}}\) phản ứng hết. Dung dịch X gồm \(Zn{{(N{{O}_{3}})}_{2}}\)và \(Cu{{(N{{O}_{3}})}_{2}}\) \((1)Zn+2A{{g}^{+}}\to Z{{n}^{2+}}+2Ag\) \((2)Zn+C{{u}^{2+}}\to Z{{n}^{2+}}+Cu\) \((3)Fe+C{{u}^{2+}}\to F{{e}^{2+}}+Cu\) +) Tính \({{n}_{C{{u}^{2+}}(3)}}\to {{n}_{C{{u}^{2+}}(2)}}\)\(\to {{m}_{Zn(R1)}}\) +) \(m={{m}_{Zn({{R}_{1}})}}+{{m}_{Zn(1)}}+{{m}_{Zn(2)}}\) Lời giải chi tiết : Dung dịch X chứa 2 muối nên \(AgN{{O}_{3}}\) phản ứng hết. Dung dịch X gồm \(Zn{{(N{{O}_{3}})}_{2}}\) và \(Cu{{(N{{O}_{3}})}_{2}}\) (Trong đó \({{R}_{1}},{{R}_{2}}\) là kí hiệu chất rắn) PTHH: \((1)Zn+2A{{g}^{+}}\to Z{{n}^{2+}}+2Ag\) 0,05 ← 0,1 → 0,1 (mol) \((2)Zn+C{{u}^{2+}}\to Z{{n}^{2+}}+Cu\) 0,1 ← 0,1 → 0,1 (mol) \((3)Fe+C{{u}^{2+}}\to F{{e}^{2+}}+Cu\) PT: 1 1 1 1 (mol) →m chất rắn ↑ = 8 gam ĐB: x m chất rắn ↑ = 6 - 5,6 = 0,4 gam → \({{n}_{C{{u}^{2+}}(3)}}=x=0,05(mol)\to {{n}_{C{{u}^{2+}}(2)}}=0,15-0,05=0,1(mol)\) \(\to {{m}_{Zn(R1)}}=26,9-0,1.108-0,1.64=9,7(g)\) Vậy \(m={{m}_{Zn({{R}_{1}})}}+{{m}_{Zn(1)}}+{{m}_{Zn(2)}}=9,7+0,05.65+0,1.65=19,45(g)\) Câu 3 : Cho hỗn hợp gồm Mg (7a mol) và Fe (4a mol) vào dung dịch chứa 0,08 mol FeCl3 và 0,16 mol CuCl2, sau một thời gian thu được dung dịch X và 7,36 gam chất rắn Y. Cho dung dịch AgNO3 dư vào X, kết thúc phản ứng thu được 84,68 gam kết tủa. Nếu cho NaOH dư vào X (không có mặt oxi) thu được 24,72 gam các hiđroxit kim loại. Lấy 7,36 gam Y hòa tan trong dung dịch HNO3 loãng dư thu được 0,08 mol khí NO duy nhất và dung dịch T chứa m gam muối. Giá trị của m là
Đáp án : B Phương pháp giải : +) Bảo toàn điện tích => \({{n}_{O{{H}^{-}}}}={{n}_{C{{l}^{-}}}}\) +) Tính mkim loại trong X +) Bảo toàn khối lượng cho kim loại => a +) \({{n}_{AgCl}}={{n}_{C{{l}^{-}}}}=>{{n}_{Ag}}\) +) Xét Y chứa những gì +) Bảo toàn electron \(=>{{n}_{N{{H}_{4}}N{{O}_{3}}}}\) => mmuối Lời giải chi tiết : Bảo toàn điện tích => \({{n}_{O{{H}^{-}}}}={{n}_{C{{l}^{-}}}}=0,56\) => mkim loại trong X = 24,72 – 0,56.17 = 15,2 Bảo toàn khối lượng cho kim loại: 24.7a + 56.4a + 0,08.56 + 0,16.64 = 15,2 + 7,36 => a = 0,02 \({{n}_{AgCl}}={{n}_{C{{l}^{-}}}}=0,56=>{{n}_{Ag}}=0,04\) => \({{n}_{F{{e}^{2+}}}}=0,04\) => mới có 0,02 mol Mg phản ứng, Fe3+ còn dư, Fe và Cu2+ chưa phản ứng Chất rắn Y chứa: nMg = 7a – 0,04/2 = 0,12 nFe = 4a = 0,08 Y phản ứng với HNO3, bảo toàn electron: 0,12.2 + 0,08.3 \(=3.{{n}_{NO}}+8.{{n}_{N{{H}_{4}}N{{O}_{3}}}}\) \(=>{{n}_{N{{H}_{4}}N{{O}_{3}}}}=0,03\) => mmuối = 7,36 + 62.(0,12.2 + 0,08.3) + 80.0,03 = 39,52 Câu 4 : Hỗn hợp X gồm Mg, Al, Zn. Cho 6,5 gam hỗn hợp X vào 200 ml dung dịch Ba(OH)2 0,5M và KOH 1M, kết thúc phản ứng thu được 4,256 lít khí H2 (đktc). Nếu cho 13 gam hỗn hợp X tác dụng với một lượng dung dịch H2SO4 loãng đến khi ngừng thoát khí thu được 4,032 lít H2 (đktc) và chất rắn không tan Y. Cho Y vào 200 ml dung dịch chứa AgNO3 1M và Cu(NO3)2 2M, sau khi phản ứng xảy ra hoàn toàn thu được 34,4 gam chất rắn X. Thành phần phần trăm số mol của Zn trong X là
Đáp án : C Phương pháp giải : Đặt a, b, c là số mol Mg, Al, Zn trong 6,5 gam X => PT (1) tính khối lượng hh X +) \({{n}_{O{{H}^{-}}}}>\text{ 2}\text{.}{{n}_{{{H}_{2}}}}\) => kiềm dư, Al và Zn tan hết => PT (2) tính số mol H2 sinh ra theo Al và Zn Nếu chỉ có Ag+ phản ứng thì mZ = mAg Nếu cả Ag+ và Cu2+ đều hết thì mZ = mAg + mCu So sánh với mZ thực tế => Ag+ hết, Cu2+ chưa hết => Y tan hết Bảo toàn electron cả quá trình cho 13 gam X : \(2.{{n}_{Mg}}+3.{{n}_{Al}}+2.{{n}_{Zn}}=2.{{n}_{{{H}_{2}}}}+1.{{n}_{A{{g}^{+}}}}+2.{{n}_{C{{u}^{2+}}}}\)pứ => nCu2+ pư mZ = mAg + mCu => PT(3) Giải hệ (1), (2), (3) => a; b; c Lời giải chi tiết : ${{n}_{Ba{{(OH)}_{2}}}}=0,1\,mol;\,{{n}_{K\text{O}H}}=0,2\,mol\Rightarrow {{n}_{O{{H}^{-}}}}=0,1.2+0,2=0,4\,mol$ Đặt a, b, c là số mol Mg, Al, Zn trong 6,5 gam X => 24a + 27b + 65c = 6,5 (1) \({{n}_{O{{H}^{-}}}}=0,4\text{ }mol>\text{ 2}\text{.}{{n}_{{{H}_{2}}}}=2.0,19=0,38\) => kiềm dư, Al và Zn tan hết => 3b + 2c = 0,19.2 (2) \({{n}_{A{{g}^{+}}}}=0,2\,mol;\,\,{{n}_{C{{u}^{2+}}}}=0,4\,mol\) Nếu chỉ có Ag+ phản ứng thì mZ = mAg = 21,6 Nếu cả Ag+ và Cu2+ đều hết thì mZ = mAg + mCu = 47,2 Thực tế 21,6 < mZ < 47,2 nên Ag+ hết, Cu2+ chưa hết => Y tan hết Bảo toàn electron cả quá trình cho 13 gam X : \(2.{{n}_{Mg}}+3.{{n}_{Al}}+2.{{n}_{Zn}}=2.{{n}_{{{H}_{2}}}}+1.{{n}_{A{{g}^{+}}}}+2.{{n}_{C{{u}^{2+}}}}\)pứ => 2.(2a + 3b + 2c) = 2.0,18 + 0,2.1 + 2.nCu2+ pư => nCu2+ pư = 2a + 3b + 2c – 0,28 mZ = mAg + mCu = 21,6 + 64.(2a + 3b + 2c – 0,28) = 34,4 (3) Giải hệ (1), (2), (3) => a = 0,05; b = 0,1; c = 0,04 => %nZn = 21,05% Câu 5 : Cho hỗn hợp Mg và Cu tác dụng với 200 ml dung dịch chứa hỗn hợp 2 muối AgNO3 0,3M và Cu(NO3)2 0,25M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch A và chất rắn B. Cho A tác dụng với dung dịch NaOH dư, lọc kết tủa đem nung đến khối lượng không đổi được 3,6 gam hỗn hợp X gồm 2 oxit. Hòa tan hoàn toàn B trong dung dịch H2SO4 đặc nóng thu được 2,016 lít SO2 (đktc). Phần trăm khối lượng Mg trong hỗn hợp đầu là
Đáp án : C Phương pháp giải : Ban đầu đặt a và b là số mol của Mg và Cu \({{n}_{A{{g}^{+}}}}=0,06\text{ }mol;\text{ }{{n}_{C{{u}^{2+}}}}=0,05\text{ }mol;\text{ }{{n}_{S{{O}_{2}}}}=0,09\text{ }mol\) Bảo toàn electron toàn bộ quá trình: 2.nMg + 2.nCu = 2.nSO2 => PT (1) Dung dịch A chứa Mg2+ (a mol), Cu2+ và NO3- (0,16 mol) Bảo toàn điện tích => nCu2+ => mX = PT (2) Từ (1) và (2) => a và b Lời giải chi tiết : Ban đầu đặt a và b là số mol của Mg và Cu \({{n}_{A{{g}^{+}}}}=0,06\text{ }mol;\text{ }{{n}_{C{{u}^{2+}}}}=0,05\text{ }mol;\text{ }{{n}_{S{{O}_{2}}}}=0,09\text{ }mol\) Bảo toàn electron: 2a + 2b = 0,09.2 (1) Dung dịch A chứa Mg2+ (a mol), Cu2+ và NO3- (0,16 mol) Bảo toàn điện tích => nCu2+ = 0,08 – a (mol) => mX = 40a + 80.(0,08 – a) = 3,6 (2) Từ (1) và (2) => a = 0,07 và b = 0,02 => %mMg = 56,8% Câu 6 : Khi nhúng thanh Mg có khối lượng m gam vào dung dịch hỗn hợp X chứa a mol Cu(NO3)2 và b mol HCl ta có đồ thị biểu diễn sự phụ thuộc của khối lượng Mg vào thời gian phản ứng được biểu diễn như hình vẽ dưới đây: Sau khi phản ứng xảy ra hoàn toàn, rút thanh Mg ra, thu được NO là sản phẩm khử duy nhất của N+5. Tỉ lệ a : b là
Đáp án : A Phương pháp giải : Đoạn 1: Khối lượng Mg giảm 18 gam (0,75 mol) 3Mg + 8H+ + 2NO3- → 3Mg2+ + 2NO + 4H2O => số mol H+ phản ứng với Mg và NO3- (1) Đoạn 2: Khối lượng Mg tăng 18 – 8 = 10 gam +) Sử dụng tăng giảm khối lượng => a Đoạn 3: Khối lượng Mg giảm 14 – 8 = 6 gam => nMg = 0,25 mol Mg + 2H+ → Mg2+ + H2 => số mol H+ phản ứng với Mg tạo H2 (2) => b = nH+ (1) + nH+ (2) => a : b Lời giải chi tiết : Đoạn 1: Khối lượng Mg giảm 18 gam (0,75 mol) 3Mg + 8H+ + 2NO3- → 3Mg2+ + 2NO + 4H2O 0,75 → 2 Đoạn 2: Khối lượng Mg tăng 18 – 8 = 10 gam Mg + Cu2+ → Mg2+ + Cu a a a ∆m = 64a – 24a = 10 => a = 0,25 Đoạn 3: Khối lượng Mg giảm 14 – 8 = 6 gam => nMg = 0,25 mol Mg + 2H+ → Mg2+ + H2 0,25 → 0,5 Vậy nH+ = b = 2 + 0,5 = 2,5 => a : b = 1 : 10 Câu 7 : Cho 19,24 gam hỗn hợp gồm Mg, Fe, Cu vào dung dịch chứa Fe(NO3)3 0,75M và Cu(NO3)2 0,5M. Sau khi kết thúc phản ứng thu được dung dịch Y có chứa 2 muối và 20,56 gam chất rắn Z. Cho 350 ml dung dịch NaOH 1,2M vào dung dịch Y, lọc bỏ kết tủa, cô cạn dung dịch nước lọc, lấy phần rắn đem nung đến khối lượng không đổi thu được 28,11 gam chất rắn khan. Cho dung dịch HCl dư vào rắn Z thấy thoát ra 2,688 lít khí H2 (đktc). Phần trăm khối lượng của Mg có trong hỗn hợp X gần nhất với
Đáp án : C Phương pháp giải : +) Vì dung dịch Y chứa 2 muối => Y gồm Mg(NO3)2 và Fe(NO3)2 => chất rắn Z gồm Cu và có thể có Fe Y + NaOH → dd gồm NaNO3 (a mol) và NaOH dư (b mol) => nNaOH ban đầu = PT (1) +) mrắn = mNaNO2 + nNaOH => PT(2) Từ (1) và (2) => a và b Đặt x là thể tích dung dịch muối ban đầu Bảo toàn gốc NO3: $3.{{n}_{F\text{e}{{(N{{O}_{3}})}_{3}}}}+2.{{n}_{Cu{{(N{{O}_{3}})}_{2}}}}={{n}_{NaN{{\text{O}}_{3}}}}$=> x Dung dịch Y chứa Mg2+ (u mol); Fe2+ (v mol) và NO3- (0,39 mol) Bảo toàn điện tích => Pt ẩn u, v Bảo toàn kim loại : \({{m}_{hh(Mg,Fe,Cu)}}+{{m}_{Fe(trong\text{ }Fe{{\left( N{{O}_{3}} \right)}_{3}})}}+{{m}_{Cu(trong\text{ }Cu{{(N{{O}_{3}})}_{2}})}}={{m}_{M{{g}^{2+}}(trongY)}}+{{m}_{F{{e}^{2+}}(trong\text{ }Y)}}+{{m}_{Z}}\) => PT ẩn u, v => u và v Lời giải chi tiết :
Vì dung dịch Y chứa 2 muối => Y gồm Mg(NO3)2 và Fe(NO3)2 => chất rắn Z gồm Cu và có thể có Fe Y + NaOH → dd gồm NaNO3 (a mol) và NaOH dư (b mol) => nNaOH ban đầu = a + b = 0,42 (1) 2NaNO3 $\xrightarrow{{{t}^{o}}}$ 2NaNO2 + O2 a mol → a mol => mrắn = mNaNO2 + nNaOH => 69a + 40b = 28,11 (2) Từ (1) và (2) => a = 0,39 và b = 0,03 Đặt x là thể tích dung dịch muối ban đầu $\Rightarrow {{n}_{F\text{e}{{(N{{O}_{3}})}_{3}}}}=0,75\text{x}\,(mol);\,{{n}_{Cu{{(N{{O}_{3}})}_{2}}}}=0,5\text{x}\,(mol)$ Bảo toàn gốc NO3: $3.{{n}_{F\text{e}{{(N{{O}_{3}})}_{3}}}}+2.{{n}_{Cu{{(N{{O}_{3}})}_{2}}}}={{n}_{NaN{{\text{O}}_{3}}}}$ => 0,75x.3 + 0,5x.2 = 0,39 => x = 0,12 Dung dịch Y chứa Mg2+ (u mol); Fe2+ (v mol) và NO3- (0,39 mol) Bảo toàn điện tích => 2u + 2v = 0,39 Bảo toàn kim loại : \({{m}_{hh(Mg,Fe,Cu)}}+{{m}_{Fe(trong\text{ }Fe{{\left( N{{O}_{3}} \right)}_{3}})}}+{{m}_{Cu(trong\text{ }Cu{{(N{{O}_{3}})}_{2}})}}={{m}_{M{{g}^{2+}}(trongY)}}+{{m}_{F{{e}^{2+}}(trong\text{ }Y)}}+{{m}_{Z}}\) => 19,24 + 0,75x.56 + 0,5x.64 = 24u + 56v + 20,56 => u = 0,105 và v = 0,09 => \(\%{{m}_{Mg}}=\frac{24u}{19,24}.100\%=13,1\%\) Câu 8 : Nung m gam hỗn hợp X gồm bột Al và Fe3O4 sau một thời gian thu được chất rắn Y. Để hòa tan hết Y cần V ml dung dịch H2SO4 0,7M (loãng). Sau phản ứng thu được dung dịch Z và 9,846 lít khí (đo ở 1,5atm; 270C). Cho dung dịch NaOH vào dung dịch Z đến dư, thu được kết tủa M. Nung M trong chân không đến khối lượng không đổi thu được 44 gam chất rắn T.
Đáp án : D Phương pháp giải : Giả sử T chứa x mol oxit FeO và y mol Fe2O3 (hiđroxit nhôm tan trong kiềm) => m Lời giải chi tiết :
Giả sử T chứa x mol oxit FeO và y mol Fe2O3 (hiđroxit nhôm tan trong kiềm) => Al dư => nAl dư $=\frac{0,6-0,45}{1,5}=0,1\,mol$ => nAl ban đầu = 0,1 + 0,4 = 0,5 mol => V = 2 lít = 2000 ml Câu 9 : Thực hiện phản ứng nhiệt nhôm hỗn hợp Al, Fe2O3, Cr2O3 sau một thời gian thu được hỗn hợp chất rắn X. Chia X thành 2 phần bằng nhau. Hòa tan hoàn toàn phần 1 trong dung dịch H2SO4 đặc, nóng, dư, sau khi các phản ứng xảy ra hoàn toàn, thu được 2,016 lít khí SO2 (sản phẩm khử duy nhất, đktc). Hòa tan hết phần 2 trong 400 ml dung dịch HNO3 2M, thu được dung dịch Y và khí NO (sản phẩm khử duy nhất của N+5). Cho từ từ dung dịch NaOH 1M đến dư vào Y thu được kết quả như hình vẽ sau:
Khối lượng Cr2O3 trong hỗn hợp ban đầu là
Đáp án : C Phương pháp giải : +) Tại điểm khối lượng kết tủa không đổi => chỉ có Fe(OH)3 +) Tính nHNO3 pư Phần 1: Cho X tác dụng với H2SO4 đặc cũng như cho hỗn hợp đầu tác dụng BT e: \(3{{n}_{Al~}}=2{{n}_{S{{O}_{2}}}}~=>{{n}_{Al}}~\) Phần 2: Cho X tác dụng với HNO3 cũng như cho hỗn hợp đầu tác dụng Tính số mol Cr2O3 theo PTHH Lời giải chi tiết : Quan sát đồ thị ta thấy: \({{m}_{Fe{{\left( OH \right)}_{3}}}}=5,136\text{ }gam\Rightarrow {{n}_{Fe{{\left( OH \right)}_{3}}}}=0,048\text{ }mol\) nHNO3 dư = 0,296 mol => nHNO3 pư = 0,8 – 0,296 = 0,504 mol Phần 1: Cho X tác dụng với H2SO4 đặc cũng như cho hỗn hợp đầu tác dụng BT e: \(3{{n}_{Al~}}=2{{n}_{S{{O}_{2}}}}~=>{{n}_{Al}}~=2.\frac{0,09}{3}=0,06\text{ }mol\) Phần 2: Cho X tác dụng với HNO3 cũng như cho hỗn hợp đầu tác dụng Al + 4HNO3 → Al(NO3)3 + NO + 2H2O 0,06→0,24 Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O 0,024 ← 0,144 ← 0,048 Cr2O3 + 6HNO3 → 2Cr(NO3)3 + 3H2O 0,02 ← 0,12 \({{m}_{C{{r}_{2}}{{O}_{3}}}}\)(1 phần) = 0,02.152 = 3,04 gam => \({{\mathbf{m}}_{\mathbf{C}{{\mathbf{r}}_{\mathbf{2}}}{{\mathbf{O}}_{\mathbf{3}}}}}~=\mathbf{6},\mathbf{08}\text{ }\mathbf{gam}\) Câu 10 : Điện phân 600 ml dung dịch X chứa đồng thời NaCl 0,5M và CuSO4 a mol/l (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước) đến khi thu được dung dịch Y có khối lượng giảm 24,25 gam so với khối lượng dung dịch X ban đầu thì ngừng điện phân. Nhúng một thanh sắt nặng 150 gam vào dung dịch Y đến khi các phản ứng xảy ra hoàn toàn, lấy thanh kim loại ra, rửa sạch, làm khô cân được 150,4 gam(giả thiết toàn bộ lượng kim loại tạo thành đều bám hết vào thanh sắt và không có sản phẩm khử của S+6 sinh ra). giá trị của a là
Đáp án : A Phương pháp giải : Viết các bán phản ứng xảy ra tại catot, anot Dùng bảo toàn e đối với quá trình điện phân Tăng giảm khối lượng đối với dd Y + Fe Lời giải chi tiết : Dung dịch Y thu được tác dụng với thanh Fe làm cho thanh Fe tăng khối lượng nên Y có Cu2+ dư Xét phản ứng điện phân dung dịch X Tại K (-): Cu+2 + 2e → Cu Tại A (+) : 2Cl - → Cl2 + 2e nNaCl = 0,6.0,5=0,3 mol Giả sử Cl- điện phân hết thì nCu = =0,15 mol → mdd giảm = mCu + mCl2 = 0,15.64 + 0,3.35,5 = 20,25 < 24,25 => vô lí → tại A xảy ra thêm phản ứng sau: 2H2O → O2 + 4H+ + 4e y → 4y → 4y (mol) → nCu phản ứng = → mdung dịch giảm = mCu + mCl2 + mO2 => 64. (0,15+2y) + 0,15.71 + 32y = 24,25 => y = 0,025 (mol) Dung dịch Y chứa: H+: 0,1 (mol); Cu2+ dư: z (mol) ; SO42-, Na+ Xét dung dịch Y phản ứng vói Fe Fe + Cu2+ → Fe2+ + Cu↓ z ← z → z (mol) Fe + 2H+ → Fe2+ + H2↑ 0,05 ←0,1 (mol) Khối lượng kim loại tăng = mCu - mFe pư => 150,04 -150 = 64z - (z + 0,05).56 => z = 0,4 => nCu2+ ban đầu = 0,15 + 2y+ z = 0,15 + 2.0,025 + 0,4 = 0,6 (mol) → a = 0,6 : 0,6 = 1M Câu 11 : Cho 9,2 gam hỗn hợp X gồm Mg và Fe cho vào dung dịch AgNO3 và Cu(NO3)2 được chất rắn Y gồm 3 kim loại và dung dịch . Hòa tan hết Y bằng dung dịch H2SO4 đặc nóng thu được 6,384 lít SO2 (đktc) – sản phầm khử duy nhất. Cho NaOH dư vào Z thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi thu được 8,4 gam hỗn hợp rắn khan. Các phản ứng xảy ra hoàn toàn . % khối lượng Fe ban đầu là
Đáp án : B Phương pháp giải : \(Mg,Fe + (A{g^ + },C{u^{2 + }}) \to \left\langle \begin{gathered}Y:Ag,Cu,Fe\xrightarrow{{ + {H_2}S{O_4}dac,{t^0}}}\underbrace {S{O_2}}_{0,285\,mol} + (F{e^{3 + }},C{u^{2 + }},A{g^ + }) \\Z:M{g^{2 + }},Z{n^{2 + }}\xrightarrow{{ + NaOH}}\underbrace{Mg{{(OH)}_2},Fe{{(OH)}_2}}_T\xrightarrow{{{t^0}}}\underbrace {MgO,F{e_2}{O_3}}_{8,4\,(g)}\\\end{gathered} \right.\) Gọi số mol Mg là x; Fe trong Y là y và Fe trong Z là z →pt m hỗn hợp ban đầu Bảo toàn e : 2x + 3y + 2z = 2nSO2 Pt khối lương T Lời giải chi tiết : \(Mg,Fe + (A{g^ + },C{u^{2 + }}) \to \left\langle \begin{gathered}Y:Ag,Cu,Fe\xrightarrow{{ + {H_2}S{O_4}dac,{t^0}}}\underbrace {S{O_2}}_{0,285\,mol} + (F{e^{3 + }},C{u^{2 + }},A{g^ + }) \\Z:M{g^{2 + }},Z{n^{2 + }}\xrightarrow{{ + NaOH}}\underbrace{Mg{{(OH)}_2},Fe{{(OH)}_2}}_T\xrightarrow{{{t^0}}}\underbrace {MgO,F{e_2}{O_3}}_{8,4\,(g)} \\\end{gathered} \right.\) Gọi số mol Mg là x; Fe trong Y là y và Fe trong Z là z → mX = 24x + 56y + 56z = 9,2 (1) Bảo toàn e : 2x + 3y + 2z = 2nSO2= 2.0,285 = 0,57 (2) mchất rắn = 40x + 80z = 8,4 (3) giải hệ (1), (2) và (3) ⇒ x = 0,15 ; y = 0,07 ; z = 0,03 → %Fe = (0,1.56.100)/9,2 = 60,87% Câu 12 : Cho 11,04 gam hỗn hợp X gồm Mg và Fe vào 150 ml dung dịch chứa AgNO3 a mol/lít và Cu(NO3)2 2a mol/lít, khi phản ứng kết thúc thu được chất rắn Y và dung dịch Z. Hòa tan hoàn toàn Y bằng dung dịch H2SO4 đặc nóng dư thu được 7,56 lít khí SO2 (đktc) (sản phẩm khử duy nhất). Cho Z tác dụng với NaOH dư, thu được kết tủa T. Nung T trong không khí đến khối lượng không đổi thu được 10,8 gam hỗn hợp rắn E. Giá trị của a là:
Đáp án : C Phương pháp giải : Gọi nMg, nFe phản ứng, nFe dư lần lượt là x,y,z Từ dữ kiện đề bài lập hệ phương trình 3 ẩn =>a Lời giải chi tiết : Ta có: nAgNO3 = 0,15a mol; nCu(NO3)2 = 0,15.2a = 0,3a mol; nSO2 = 0,3375 mol Chất rắn sau khi nung nặng 10,8 gam nên toàn bộ lượng Mg và Fe không chuyển hết về oxit trong E được (Lúc đó khối lượng chất rắn E phải lớn hơn 11,04 gam). Vậy trong Y phải có Fe dư. → AgNO3 và Cu(NO3)2 đã phản ứng hết. Đặt số mol Mg, Fe phản ứng và Fe dư lần lượt là x, y, z mol Ta có: mhỗn hợp X = 24x + 56y + 56z = 11,04 gam (1) Khi cho Y tác dụng với H2SO4 đặc nóng dư theo bảo toàn electron ta có: 2x + 2y + 3z = 2.0,3375 (*) ↔2x + 2y + 3z = 0,675 (2) Hỗn hợp rắn E gồm x mol MgO và y/2 mol Fe2O3 → 40x + 160.y/2 = 10,8 gam (3) Giải hệ 3 phương trình trên ta có: x = 0,18; y = 0,045 và z = 0,075 Thay z vào (*) ta có: a = 0,6 Câu 13 : Cho 4,58 gam hỗn hợp A gồm Zn, Fe và Cu vào cốc đựng 85 ml dung dịch CuSO4 1M. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch B và kết tủa C. Nung C trong không khí đến khối lượng không đổi được 6 gam chất rắn D. Thêm dung dịch NaOH dư vào dung dịch B, lọc kết tủa thu được, rửa sạch rồi nung ở nhiệt độ cao đến khối lượng không đổi thu được 5,2 gam chất rắn E. Các phản ứng xảy ra hoàn toàn. % khối lượng mỗi kim loại trong hỗn hợp A (theo thứ tự Zn, Fe, Cu) là:
Đáp án : A Phương pháp giải : - từ mkim loại, lượng CuSO4 => CuSO4 dư Gọi nFe, nZn,nCu lần lượt là a, b, c Từ dữ kiện bài toán lập hệ phương trình 3 ẩn => a, b, c
Lời giải chi tiết : nKL < 4,58:56 =0,081 <nCuSO4 => Sau phản ứng CuSO4 còn dư Gọi nFe, nZn, nCu trong hỗn hợp kim loại lần lượt là a, b,c => 56a + 65b + 64c = 4,58 (1) Kết tủa C gồm có: Cu có trong kim loại (c mol) và Cu sinh ra (a+b) mol Sau khi nung (a+b+c) mol Cu => (a+b+c) mol CuO => a+b+c = 6:80 = 0,075 (2) Dung dịch B gồm: FeSO4 (a mol); ZnSO4 (b mol); CuSO4 (0,085 -a-b) mol => Khi tác dụng NaOH thì kết tủa thu được là Fe(OH)2 (a mol); Cu(OH)2 (0,085 -a-b) mol Sau khi nung, chất rắn gồm: Fe2O3 (a/2 mol); CuO (0,085 -a -b) mol => 80a + (0,085 -a -b)*80 = 5,2 (3) Từ (1); (2); (3) => a=0,03; b=0,02; c=0,025 => % Fe = 0,03 * 56/ 4,58 = 36,68% %Zn = 0,02 * 65/4,58 = 28,38 % %Cu = 34,94%
|