Trắc nghiệm Tổng hợp bài tập điện phân hỗn hợp muối - Hóa 12Đề bài Câu 1 : Điện phân dung dịch gồm a mol CuSO4 và 2a mol NaCl sau khi ở catot bắt đầu thoát khí thì dừng lại. Chất tan trong dung dịch thu được sau điện phân là
Câu 2 : Điện phân một dung dịch gồm a mol CuSO4 và b mol NaCl. Nếu b > 2a mà ở catot chưa có khí thoát ra thì dung dịch sau điện phân chứa
Câu 3 : Điện phân dung dịch hồn hợp chứa 0,04 mol AgNO3 và 0,05 mol Cu(NO3)2, điện cực trơ, dòng điện 5A, trong 32 phút 10 giây. Khối lượng kim loại bám vào catot là
Câu 4 : Điện phân dung dịch X gồm 0,04 mol AgNO3 và 0,06 mol Fe(NO3)3 với I = 5,36A, điện cực trơ, sau t giây thấy catot tăng 5,44 gam. Giá trị của t là
Câu 5 : Điện phân 500 ml dung dịch hỗn họp FeSO4 0,1M, Fe2(SO4)3 0,2M và CuSO4 0,1M với điện cực trơ. Điện phân cho đến khi khối lượng catot tăng 8,8 gam thì ngừng điện phân. Biết cường độ dòng điện đem điện phân là 10A. Thời gian điện phân là:
Câu 6 : Điện phân 400ml dd AgNO3 0,2M và Cu(NO3)2 0,1M với cường độ dòng điện I = 10A, anot bằng Pt. Sau thời gian t, ta ngắt dòng điện, thấy khối lượng catot tăng thêm m gam trong đó có 1,28 gam Cu. Thời gian điện phân t là (hiệu suất điện phân là 100%)
Câu 7 : Điện phân 200 ml dung dịch hỗn hợp AgNO3 0,1 M và Cu(NO3)2 0,2 M với điện cực trơ và cường độ dòng điện bằng 5A. Sau 19 phút 18 giây dừng điện phân, lấy catot sấy khô thấy tăng m gam. Giá trị của m là:
Câu 8 : Điện phân 200 ml dung dịch AgNO3 0,4M và Cu(NO3)2 0,2M với điện cực trơ. Sau một thời gian điện phân lấy catot ra làm khô cân lại thấy tăng m gam, trong đó có 1,28 gam Cu. Giá trị của m là
Câu 9 : Tiến hành điện phân hoàn toàn dung dịch X chứa 200 ml dung dịch AgNO3 và Cu(NO3)2 thu được 56 gam hỗn họp kim loại ở catot và 4,48 lít khí ở anot (đktc). Nồng độ mol AgNO3 và Cu(NO3)2 trong X lần lượt là
Câu 10 : Điện phân 100 ml dung dịch CuSO4 0,2 M và AgNO3 0,1 M với cường độ dòng điện I = 3,86A. Thời gian điện phân để thu được 1,72 gam kim loại bám trên catot là:
Câu 11 : Điện phân 100 ml dung dịch X gồm KCl 0,1M và Cu(NO3)2 0,2M với cường độ dòng điện 5A trong 579 giây, điện cực trơ, màng ngăn xốp. Giả sử nước bay hơi không đáng kể. Độ giảm khối lượng của dung dịch sau khi điện phân là:
Câu 12 : Điện phân với các điện cực trơ dung dịch hồn hợp gồm 0,2 mol CuSO4 và 0,12 mol HCl trong thời gian 2000 giây với dòng điện có cường độ là 9,65A (hiệu suất của quá trình điện phân là 100%). Khối lượng Cu thoát ra ở catot và thể tích khí (đktc) thoát ra ở anot là
Câu 13 : Điện phân 100 ml dung dịch chứa: FeCl3 1M, FeCl2 2M, CuCl2 1M và HCl 2M với điện cực trơ, màng ngăn xốp, I = 5A trong 2 giờ 40 phút 50 giây thì ở catot tăng m gam. Giá trị của m là
Câu 14 : Điện phân 200 ml dung dịch Y gồm KCl 0,1M và Cu(NO3)2 0,2M với cường độ dòng điện 5A trong thời gian 1158 giây, điện cực trơ, màng ngăn xốp. Giả sử nước bay hơi không đáng kể. Độ giảm khối lượng của dung dịch sau khi điện phân là
Câu 15 : Dung dịch X chứa HCl, CuSO4, Fe2(SO4)3. Lấy 400 ml dung dịch X đem điện phân với điện cực trơ, I = 7,72A đến khi ở catot thu được 5,12 gam Cu thì dừng lại. Khi đó chỉ thu được 0,1 mol một chất khí duy nhất thoát ra ở anot. Thời gian điện phân và nồng độ [Fe2+] sau điện phân lần lượt là
Câu 16 : Điện phân dung dịch chứa hỗn hợp hai muối CuCl2 và Cu(NO3)2 một thời gian, ở anot của bình điện phân thoát ra 448 ml hồn hợp khí (đktc) có tỉ khối so với H2 bằng 25,75 và có m gam kim loại Cu bám trên catot (biết trên catot không có khí thoát ra). Giá trị của m là:
Câu 17 : Điện phân dung dịch NaOH với cường độ dòng điện là 10A trong thời gian 268h. Sau khi điện phân còn lại 100 gam dung dịch NaOH có nồng độ 24%. Nồng độ của dung dịch NaOH trước điện phân là:
Câu 18 : Điện phân dung dịch hồn hợp gồm 0,1 mol FeCl3, 0,2 mol CuCl2 và 0,1 mol HCl (điện cực trơ). Khi ở catot bắt đầu thoát khí thì ở anot thu được V lít khí (đktc). Biết hiệu suất của quá trình điện phân là 100%. Giá trị của V là:
Câu 19 : Hòa tan hoàn toàn hỗn hợp X gồm KCl và CuSO4 vào nước, thu được dung dịch Y. Điện phân dung dịch Y với điện cực trơ màng ngăn xốp, đến khi H2O bị điện phân tại cả 2 điện cực thì dừng điện phân. Số mol khí ở anot thoát ra bằng 4 lần số mol khí thoát ra tại catot. Phần trăm khối lượng của CuSO4 trong X là
Câu 20 : Điện phân dung dịch X chứa a mol Cu(NO3)2 và 0,2 mol NaCl (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) trong thời gian t giây, thu được 3,36 lít khí ở anot( đktc) và dung dịch Y. Nếu thời gian điện phân là 2t giây thì tổng thể tích khí thu được ở cả 2 điện cực là 7,84 lít (đktc). Cho dung dịch Y phản ứng tối đa với m gam Fe tạo ra khí NO(sản phẩm khử duy nhất). Biết hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Giá trị của m là
Câu 21 : Hòa tan hoàn toàn m gam hỗn hợp gồm CuSO4 và FeCl3 vào nước dư thu được dung dịch X. Điện phân dung dịch X với điện cực trơ đến khi ở anot thoát ra 0,2 mol hỗn hợp khí có tỉ khối hơi so với H2 bằng 30,625 thì dừng lại. Dung dịch thu được sau điện phân có chứa 2 muối có nồng độ mol bằng nhau. Giả sử hiệu suất của quá trình điện phân là 100%, khí sinh ra không tan trong dung dịch. Giá trị của m là
Câu 22 : Dung dịch hỗn hợp X gồm NaCl 0,6M và CuSO40,5M. Điện phân 100 ml dung dịch X (điện cực trơ, màng ngăn xốp, hiệu suất 100%, bỏ qua sự hòa tan của khí trong nước hay sự bay hơi của nước) với cường độ dòng điện không đổi 0,5A trong thời gian t giây. Dung dịch sau điện phân có khối lượng giảm 4,85 gam so với dung dịch ban đầu. Giá trị của t là
Câu 23 : Điện phân dung dịch X chứa hỗn hợp gồm CuSO4 và NaCl (tỉ lệ mol tương ứng 1:3) với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi 2A. Sau thời gian điện phân t (giờ) thu được dung dịch Y (chứa 2 chất tan) có khối lượng giảm 12,45 gam so với dung dịch X. Dung dịch Y phản ứng vừa hết với 3,06 gam Al2O3. Bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước, hiệu suất điện phân 100%. Giá trị của t gần nhất với giá trị nào sau đây?
Câu 24 : Điện phân dung dịch X gồm 0,2 mol NaCl và a mol Cu(NO3)2 (với các điện cực trơ, màng ngăn xốp, cường độ dòng điện không thay đổi), thu được dung dịch Y có khối lượng giảm 17,5 gam so với khối lưọng của X. Cho m gam Fe vào Y đến khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Z, khí NO (sản phẩm khử duy nhất của N+5) và (m - 0,5) gam hỗn hợp kim loại. Giả thiết hiệu suất điện phân là 100%, nước bay hơi không đáng kể. Giá trị của a là
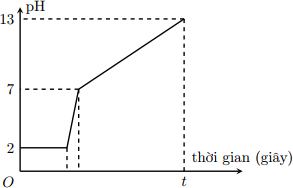
Câu 25 : Điện phân 800 ml dung dịch gồm NaCl, HCl và CuCl2 0,02M (điện cực trơ, màng ngăn xốp) với cường độ dòng điện 9,65A. Mối liên hệ giữa thời gian điện phân và pH của dung dịch điện phân được biểu diễn bằng đồ thị dưới đây (giả sử muối đồng không bị thủy phân):
Giá trị của t trên đồ thị là
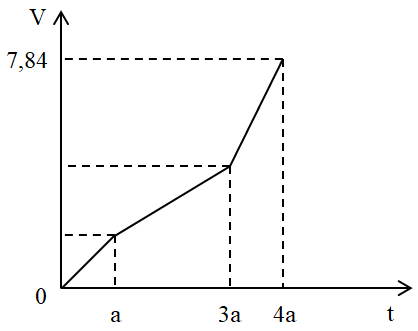
Câu 26 : Điện phân dung dịch X chứa Cu(NO3)2 và NaCl với điện cực trơ. Tổng thể tích khí thoát ra ở cả 2 điện cực (V lít) phụ thuộc vào thời gian điện phân (t giây) theo đồ thị bên. Nếu điện phân X trong thời gian 3,5a giây thì thu được dung dịch có khối lượng giảm m gam so với dung dịch X. Giả thiết các chất điện phân ra không tan trong dung dịch. Giá trị của m là:
Câu 27 : Điện phân (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) dung dịch X chứa a mol MSO4 (M là kim loại) và 0,3 mol KCl trong thời gian t giây, thu được 2,24 lít khí ở anot (đktc) và dung dịch Y có khối lượng giảm m gam so với khối lượng dung dịch X. Nếu thời gian điện phân là 2t giây thì thu được dung dịch Z có khối lượng giảm 19,6 gam so với khối lượng dung dịch X. Biết hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Phát biểu nào sau đây là đúng?
Câu 28 : Điện phân dung dịch chứa m gam hỗn hợp gồm Cu(NO3)2 và NaCl bằng điện cực trơ, màng ngăn xốp với cường độ dòng điện I = 5A, sau thời gian 6176 giây thì dừng điện phân. Để yên bình điện phân đến khi phản ứng xảy ra hoàn toàn, thu được 0,06 mol khí NO (sản phẩm khử duy nhất của N+5) và dung dịch X. Cho 400 ml dung dịch NaOH 1M vào X, lọc bỏ kết tủa, thu được dung dịch Y không màu. Cô cạn Y, lấy phần rắn đem nung đến khối lượng không đổi, thu được 29,64 gam chất rắn. Giá trị m là
Câu 29 : Hòa tan hoàn toàn m gam hỗn hợp gồm CuSO4 và FeCl3 vào nước dư thu được dung dịch X. Điện phân dung dịch X với điện cực trơ đến khi ở anot thoát ra 0,2 mol hỗn hợp khí có tỉ khối hơi so với H2 bằng 30,625 thì dừng lại. Dung dịch thu được sau điện phân có chứa 2 muối có nồng độ mol bằng nhau. Giả sử hiệu suất của quá trình điện phân là 100%, khí sinh ra không tan trong dung dịch. Giá trị của m là
Câu 30 : Điện phân dung dịch X chứa m gam CuSO4 và 0,2 mol KCl (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi). Trong thời gian t giây, thu được 2,464 lít khí ở anot (đktc). Nếu thời gian điện phân là 2t giây thì tổng thể tích khí thu được ở cả hai điện cực là 5,824 lít (đktc). Biết hiệu suất điện phân là 100%, các khí sinh ra không tan trong dung dịch. Giá trị của m là:
Câu 31 : Điện phân dung dịch X chứa KCl, K2SO4, CuSO4 với điện cực trơ, màng ngăn xốp trong t giây thu được dung dịch Y; ở anot thu được 4,312 lít hỗn hợp khí (đktc); khối lượng catot tăng lên 16,64 gam. Cho dung dịch Y tác dụng với dung dịch Ba(OH)2 dư thu được 114,65 gam hỗn hợp kết tủa. Điện phân dung dịch X trong thời gian 2t giây thu được 10,808 lít khí (đktc) ở cả hai điện cực. Khối lượng chất tan trong dung dịch X là
Lời giải và đáp án Câu 1 : Điện phân dung dịch gồm a mol CuSO4 và 2a mol NaCl sau khi ở catot bắt đầu thoát khí thì dừng lại. Chất tan trong dung dịch thu được sau điện phân là
Đáp án : C Lời giải chi tiết : (1) 2NaCl + CuSO4 → Cu +Cl2 + Na2SO4 Ở (1) NaCl phản ứng vừa đủ với CuSO4 => Dung dịch sau điện phân chỉ có Na2SO4 Câu 2 : Điện phân một dung dịch gồm a mol CuSO4 và b mol NaCl. Nếu b > 2a mà ở catot chưa có khí thoát ra thì dung dịch sau điện phân chứa
Đáp án : D Phương pháp giải : xem lại lí thuyết điện phân hỗn hợp Lời giải chi tiết : Catot (-) Cu2+, Na+, H2O Anot (+) SO42- , Cl-, H2O (1) Cu2+ + 2e → Cu (1) 2Cl- → Cl2 + 2e a → 2a → a b → b/2 → b Vì catot chưa có khí thoát ra và b>2a => Dung dịch sau điện phân chứa: Na+, SO42-, Cu2+, Cl-. Câu 3 : Điện phân dung dịch hồn hợp chứa 0,04 mol AgNO3 và 0,05 mol Cu(NO3)2, điện cực trơ, dòng điện 5A, trong 32 phút 10 giây. Khối lượng kim loại bám vào catot là
Đáp án : A Phương pháp giải : Tính ${{n}_{{{e}_{td}}}}=\dfrac{It}{F}$ Xác định chất bị điện phân : gồm Ag+ và Cu2+ Tìm số mol từng kim loại => Khối lượng kim loại bám vào catot Lời giải chi tiết : ${n_{{e_{td}}}} = \dfrac{{5.1930}}{{96500}} = 0,1 mol$ Catot gồm Ag+ và Cu2+ bị oxi hóa Ag+ + 1e → Ag 0,04 0,04 Cu2+ + 2e → Cu 0,06 →0,03 =>$\left\{\begin{gathered}{n_{Ag}} = 0.04\,mol \\ {n_{Cu}} = \dfrac{{0,1 - 0,04}}{2} = 0,03mol \hfill \\ \end{gathered} \right. $ => mKL= 0,04.108 + 0,03.64 = 6,24g Câu 4 : Điện phân dung dịch X gồm 0,04 mol AgNO3 và 0,06 mol Fe(NO3)3 với I = 5,36A, điện cực trơ, sau t giây thấy catot tăng 5,44 gam. Giá trị của t là
Đáp án : A Phương pháp giải : Từ mcatot tăng => Khối lượng kim loại bám vào Xác định chất bị điện phân : gồm Ag+ và Fe3+ bị điện phân 1 phần Tính ${{n}_{{{e}_{td}}}}=\dfrac{It}{F}\Rightarrow t$ Lời giải chi tiết : mAg = 4,32g => mFe(bị điện phân) = 5,44 – 4,32 = 1,12g => nFe = 0,02 mol Ag+ + 1e → Ag 0,04 0,04 Fe3++ 1e → Fe2+ 0,06 0,06 Fe2+ + 2e → Fe 0,04 0,02 => netđ= 0,04 + 0,1 = 0,14 mol Mà ${{n}_{{{e}_{td}}}}=\dfrac{It}{F}=0,1 mol$ => $t=\dfrac{F.{{n}_{{{e}_{t\text{d}}}}}}{I} =\dfrac{96500.0,14}{5,36}=2520,522s$ Câu 5 : Điện phân 500 ml dung dịch hỗn họp FeSO4 0,1M, Fe2(SO4)3 0,2M và CuSO4 0,1M với điện cực trơ. Điện phân cho đến khi khối lượng catot tăng 8,8 gam thì ngừng điện phân. Biết cường độ dòng điện đem điện phân là 10A. Thời gian điện phân là:
Đáp án : C Phương pháp giải : Từ mcatot tăng => Khối lượng kim loại bám vào Xác định chất bị điện phân : gồm Cu2+, Fe3+ và Fe2+ bị điện phân 1 phần Tính ${{n}_{{{e}_{td}}}}=\frac{It}{F}\Rightarrow t$ Lời giải chi tiết : nFe3+ = 0,2 mol ; nCu2+ = 0,05mol ; nFe2+ =0,05mol mtăng = mCu + mFe => mFe = 8,8 – 0,05.64 = 5,6g => nFe = 0,1mol Các ion đã điện phân ở catot: Fe3+ , Cu2+, Fe2+ điện phân 1 phần netđ = nFe3+ + 2nCu2+ + 2nFe2+ = 0,2 + 0,05.2 + 0,1.2 = 0,5 mol => $t=\frac{F.{{n}_{{{e}_{t\text{d}}}}}}{I} =\frac{96500.0,5}{10}=4825s$ Câu 6 : Điện phân 400ml dd AgNO3 0,2M và Cu(NO3)2 0,1M với cường độ dòng điện I = 10A, anot bằng Pt. Sau thời gian t, ta ngắt dòng điện, thấy khối lượng catot tăng thêm m gam trong đó có 1,28 gam Cu. Thời gian điện phân t là (hiệu suất điện phân là 100%)
Đáp án : B Phương pháp giải : Từ mcatot tăng => Khối lượng kim loại bám vào Xác định chất bị điện phân : gồm Ag+ và Cu2+ bị điện phân 1 phần Tính ${{n}_{{{e}_{td}}}}=\frac{It}{F}\Rightarrow t$ Lời giải chi tiết : Sinh ra 1,28 g Cu tương đương 0,02 mol Cu mà nCu(NO3)2 = 0,04 > 0,02 → Cu(NO3)2 bị điện phân 1 phần → AgNO3 điện phân hết nAgNO3 = 0,08mol Ag+ + 1e → Ag 0,08 → 0,08 Cu2+ + 2e → Cu 0,04 0,02 => netđ= 0,04 + 0,08 = 0,12 mol => $t=\frac{F.{{n}_{{{e}_{t\text{d}}}}}}{I} =\frac{96500.0,12}{10}=1158s$ Câu 7 : Điện phân 200 ml dung dịch hỗn hợp AgNO3 0,1 M và Cu(NO3)2 0,2 M với điện cực trơ và cường độ dòng điện bằng 5A. Sau 19 phút 18 giây dừng điện phân, lấy catot sấy khô thấy tăng m gam. Giá trị của m là:
Đáp án : D Phương pháp giải : Tính ${{n}_{{{e}_{td}}}}=\frac{It}{F}$ Xác định chất bị điện phân Tìm số mol từng kim loại => Khối lượng kim loại bám vào catot Lời giải chi tiết : ${{n}_{{{e}_{td}}}}=\frac{It}{F}=\frac{5.1158}{96500}=0,06 mol$ nAgNO3 = 0.02 mol , nCu(NO3)2 = 0,04 mol Ag+ + 1e → Ag 0,02....0,02 Cu2+ + 2e → Cu 0,04 →0,02 => AgNO3 điện phân hết, Cu(NO3)2 điện phân 1 phần mcatot tăng = 0,02.108 + 0,02.64 = 3,44g Câu 8 : Điện phân 200 ml dung dịch AgNO3 0,4M và Cu(NO3)2 0,2M với điện cực trơ. Sau một thời gian điện phân lấy catot ra làm khô cân lại thấy tăng m gam, trong đó có 1,28 gam Cu. Giá trị của m là
Đáp án : D Phương pháp giải : Khối lượng kim loại bám vào => Xác định chất bị điện phân Tính mcatot tăng Lời giải chi tiết : Sinh ra 1,28 g Cu tương đương 0,02 mol Cu mà nCu(NO3)2 = 0,04 > 0,02 → Cu(NO3)2 bị điện phân 1 phần → AgNO3 điện phân hết nAgNO3 = 0,08mol Ag+ + 1e → Ag 0,08 → 0,08 Cu2+ + 2e → Cu 0,04 0,02 => mAg = 0,08.108 = 8,64g => mcatot tăng = 8,64 + 0,02.64 = 9,92g Câu 9 : Tiến hành điện phân hoàn toàn dung dịch X chứa 200 ml dung dịch AgNO3 và Cu(NO3)2 thu được 56 gam hỗn họp kim loại ở catot và 4,48 lít khí ở anot (đktc). Nồng độ mol AgNO3 và Cu(NO3)2 trong X lần lượt là
Đáp án : A Phương pháp giải : Gọi số mol AgNO3 và Cu(NO3)2 là x và y mol Viết quá trình cho nhận e ở catot và anot Lập hệ phương trình về khối lượng catot và netđ => giải hệ tìm x,y => CM Lời giải chi tiết : nAgNO3 = x mol , nCu(NO3)2 = y mol
m(kim loại) = 56g => 108x + 64y = 56 n(khí) = 4,48/22,4 = 0,2 mol => x + 2y = 0,8 => x = 0,4 và y = 0,2 => CM(AgNO3) = 2M , CM(Cu(NO3)2) = 1M Câu 10 : Điện phân 100 ml dung dịch CuSO4 0,2 M và AgNO3 0,1 M với cường độ dòng điện I = 3,86A. Thời gian điện phân để thu được 1,72 gam kim loại bám trên catot là:
Đáp án : C Phương pháp giải : Xác định ion kim loại nào bị điện phân trước Từ số gam kim loại bám trên catot => số mol các chất phản ứng Tính ${n_{{e_{td}}}} = \frac{{It}}{F}$ Lời giải chi tiết : Khi điện phân dung dịch chứa nhiều ion kim loại, ion nào có tính oxy hóa mạnh bị điện phân trước Tính oxi hóa của Ag+ > Cu2+ nên Ag+ bị điện phân trước (-) Ag+ + e → Ag 0,01 0,01 0,01 => mAg = 0,01.108 = 1,08 (gam) < 1,72 (gam) => Cu2+ bị điện phân Cu2+ + 2e → Cu 0,02 0,01 $n_{Cu}=\frac{1,72-1,08}{64}=0,01(mol)$ $\Rightarrow \sum{n}_{(e\,nhận)}=0,03(mol)$ $\Rightarrow n_{e}=\frac{It}{F}\Rightarrow t=\frac{0,03.96500}{3,86}=750(giây)$ Câu 11 : Điện phân 100 ml dung dịch X gồm KCl 0,1M và Cu(NO3)2 0,2M với cường độ dòng điện 5A trong 579 giây, điện cực trơ, màng ngăn xốp. Giả sử nước bay hơi không đáng kể. Độ giảm khối lượng của dung dịch sau khi điện phân là:
Đáp án : A Phương pháp giải : Tính ${n_{{e_{td}}}} = \frac{{It}}{F}$ Dễ dàng tính đc số mol của các chất ban đầu là 0,01 mol (KCl), 0,02 mol Cu(NO3)2 Viết quá trình xảy ra catot, anot Tính khối lượng dung dịch giảm Lời giải chi tiết : $n_{e}=\frac{It}{F}=\frac{5.579}{96500}=0,03(mol)$ Catot: nCu2+ = 0,02 (mol) Cu2+ + 2e → Cu 0,02 0,04 ne = 0,04 > 0,03 => Cu2+ dư => nCu = 0,03/2 = 0,015 (mol) Anot: nCl- = 0,01 < 0,03 => Cl- hết, có H2O điện phân 2Cl- → Cl2 + 2e 0,01 0,005 0,01 H2O → 1/2O2 + 2H+ + 2e 0,005 0,02 => m dung dịch giảm = mCu + mCl2 + mO2 = 0,015.64 + 0,005.71 + 0,005.32 = 1,475 (g) Câu 12 : Điện phân với các điện cực trơ dung dịch hồn hợp gồm 0,2 mol CuSO4 và 0,12 mol HCl trong thời gian 2000 giây với dòng điện có cường độ là 9,65A (hiệu suất của quá trình điện phân là 100%). Khối lượng Cu thoát ra ở catot và thể tích khí (đktc) thoát ra ở anot là
Đáp án : C Phương pháp giải : Tính ${n_{{e_{td}}}} = \frac{{It}}{F}$ Viết các quá trình ở catot và anot Xác định số mol mỗi chất ở điện cực dựa vào e trao đổi Lời giải chi tiết : $n_{e} = \frac{{2000.9,65}}{{96500}} = 0,2(mol)$ Do trong dung dịch điện phân có Ion Cl- nên tại cực dương giai đoạn đầu Cl- bị oxy hóa. Anot: 2Cl- → Cl2 + 2e 0,12 0,06 0,12 < 0,2 => H2O đã bị điện phân 2H2O → O2 + 4e + 4H+ 0,02 0,08 => V = (0,06 + 0,02).22,4 = 1,792 (lit) Catot: Cu2+ + 2e → Cu 0,2 0,4 > 0,2 => Cu2+ điện phân một phần => nCu = 0,2/2 = 0,1 (mol) => mCu = 0,1.64 = 6,4 (gam) Câu 13 : Điện phân 100 ml dung dịch chứa: FeCl3 1M, FeCl2 2M, CuCl2 1M và HCl 2M với điện cực trơ, màng ngăn xốp, I = 5A trong 2 giờ 40 phút 50 giây thì ở catot tăng m gam. Giá trị của m là
Đáp án : B Phương pháp giải : Tính ${n_{{e_{td}}}} = \frac{{It}}{F}$ Dựa vào thứ tự điện phân => tính khối lượng đồng Lời giải chi tiết : t=9650 (giây) $n_{e}=\frac{It}{F}=\frac{5.9650}{96500}=0,5(mol)$ Theo bài ra, dung dịch có 0,1 mol Fe3+, 0,1 mol Fe2+ và 0,1 mol Cu2+ và 0,3 mol H+ Thứ tự điện phân ở catot là : Fe3+ + 1e → Fe2+ 0,1 0,1 0,1 Cu2+ + 2e → Cu 0,1 0,2 0,1 2H+ + 2e → H2 0,2←0,2→0,1 => m = 0,1.64 = 6,4 (gam) Câu 14 : Điện phân 200 ml dung dịch Y gồm KCl 0,1M và Cu(NO3)2 0,2M với cường độ dòng điện 5A trong thời gian 1158 giây, điện cực trơ, màng ngăn xốp. Giả sử nước bay hơi không đáng kể. Độ giảm khối lượng của dung dịch sau khi điện phân là
Đáp án : D Phương pháp giải : Tính ${{n}_{{{e}_{td}}}}=\frac{It}{F}$ Viết quá trình xảy ra ở catot và anot Tính khối lương Cu Tính khối lượng dung dịch giảm Lời giải chi tiết : $n_{e}=\frac{It}{F}=\frac{5.1158}{96500}=0,06(mol)$ Dễ dàng tính đc số mol của các chất ban đầu là 0,02 mol (KCl), 0,04 mol Cu(NO3)2 Cu2+ :0,04 Cu2+ + 2e → Cu Tại Anot (+): Cl-, NO3-, H2O: Câu 15 : Dung dịch X chứa HCl, CuSO4, Fe2(SO4)3. Lấy 400 ml dung dịch X đem điện phân với điện cực trơ, I = 7,72A đến khi ở catot thu được 5,12 gam Cu thì dừng lại. Khi đó chỉ thu được 0,1 mol một chất khí duy nhất thoát ra ở anot. Thời gian điện phân và nồng độ [Fe2+] sau điện phân lần lượt là
Đáp án : B Phương pháp giải : Viết quá trình xảy ra ở catot và anot Tính nồng độ Fe2+ Tính ${{n}_{{{e}_{td}}}}=\frac{It}{F}\Rightarrow t$ Lời giải chi tiết : nCu = 0,08 (mol) Catot: Fe3+ + 1e → Fe2+ x x Cu2+ + 2e → Cu 0,08 0,16 0,08 Anot: chỉ thu được 1 khí nên phải là Cl2 2Cl- - 2e → Cl2 0,2 0,1 Theo định luật bảo toàn e, ta có: x + 0,16 = 0,2 => x = 0,04 (mol) => [Fe2+] = 0,04/0,4 = 0,1 (M) $n_{e}=\frac{It}{F}\Rightarrow t=\frac{n_{e}F}{I}=\frac{0,2.96500}{7,72}=2500(s)$ Câu 16 : Điện phân dung dịch chứa hỗn hợp hai muối CuCl2 và Cu(NO3)2 một thời gian, ở anot của bình điện phân thoát ra 448 ml hồn hợp khí (đktc) có tỉ khối so với H2 bằng 25,75 và có m gam kim loại Cu bám trên catot (biết trên catot không có khí thoát ra). Giá trị của m là:
Đáp án : C Phương pháp giải : n khí = 0,02 (mol) Do có hỗn hợp khí nên ở Anot Cl- đã điện phân hết và đến H2O điện phân Tìm số mol 2 khí Tính netđ Tính khối lượng Cu Lời giải chi tiết : n khí = 0,02 (mol) Do có hỗn hợp khí nên ở Anot Cl- đã điện phân hết và đến H2O điện phân Hỗn hợp khí là : Cl2 và O2 có số mol lần lượt là x, y. $ \Rightarrow \left\{ \begin{gathered} x + y = 0,02 \hfill \\ \frac{{71{\text{x}} + 32y}}{{2(x + y)}} = 25,75 \hfill \\ \end{gathered} \right.$$ \Rightarrow \left\{ \begin{gathered} x + y = 0,02 \hfill \\ 71{\text{x}} + 32y = 1,03 \hfill \\ \end{gathered} \right.$$ \Rightarrow \left\{ \begin{gathered} x = 0,01 \hfill \\ y = 0,01 \hfill \\ \end{gathered} \right.$ 2Cl- - 2e → Cl2 0,02 0,01 2H2O - 4e → O2 + 4H+ 0,04 0,01 => ne = 0,06 (mol) ở Catot chưa có khí thoát ra tức là Cu2+ dư => mCu = 0,03.64 = 1,92 (gam) Câu 17 : Điện phân dung dịch NaOH với cường độ dòng điện là 10A trong thời gian 268h. Sau khi điện phân còn lại 100 gam dung dịch NaOH có nồng độ 24%. Nồng độ của dung dịch NaOH trước điện phân là:
Đáp án : B Phương pháp giải : Quá trình điện phân NaOH thực chất là quá trình điện phân H2O nelectron trao đổi = 100 mol m dung dịch ban đầu = 100 + 100.32/4 + 100.2/2 = 1000 gam => C% Lời giải chi tiết : Quá trình điện phân NaOH thực chất là quá trình điện phân H2O: Ở catot: 2H2O + 2e --------> 2OH- + H2 Anot: 2H2O - 4e -------> 4H+ + O2 nelectron trao đổi = 100 mol m dung dịch ban đầu = 100 + 100.32/4 + 100.2/2 = 1000 gam C%NaOH = 0,24.100/1000 = 2,4% Câu 18 : Điện phân dung dịch hồn hợp gồm 0,1 mol FeCl3, 0,2 mol CuCl2 và 0,1 mol HCl (điện cực trơ). Khi ở catot bắt đầu thoát khí thì ở anot thu được V lít khí (đktc). Biết hiệu suất của quá trình điện phân là 100%. Giá trị của V là:
Đáp án : B Phương pháp giải : Viết các quá trình xảy ra bên catot Khi ở catot bắt đầu thoát khí nên ta dừng lại ở đây e nhận khi đó =0,5 Quá trình xảy ra bên anot => Cl- dư => VCl2 Lời giải chi tiết : khi điện phân thì bên catot ta có Fe3+ +1e -> Fe2+ 0,1 0,1 Cu2+ +2e ->Cu 0,2 -> 0,4 vì theo dữ liệu bên này bắt đầu có khí nên ta dừng lại ở đây e nhận khi đó =0,5 bên anot: 2Cl- +2e -> Cl2 Do e nhường = e nhận=0,5 mol => Cl- dư => nCl2=0,5/2=0,25mol => V = 5,6 lít Câu 19 : Hòa tan hoàn toàn hỗn hợp X gồm KCl và CuSO4 vào nước, thu được dung dịch Y. Điện phân dung dịch Y với điện cực trơ màng ngăn xốp, đến khi H2O bị điện phân tại cả 2 điện cực thì dừng điện phân. Số mol khí ở anot thoát ra bằng 4 lần số mol khí thoát ra tại catot. Phần trăm khối lượng của CuSO4 trong X là
Đáp án : D Phương pháp giải : Tại A có 2Cl- → Cl2 + 2e Tại K có Cu+2 +2e → Cu 2H2O + 2e → 2OH- +H2 Bảo toàn e và nCl2 = 4nH2 →\(\frac{{{n_{CuS{O_4}}}}}{{{n_{KCl}}}}\) Lời giải chi tiết : Tại A có 2Cl- → Cl2 + 2e Tại K có Cu+2 +2e → Cu 2H2O + 2e → 2OH- +H2 Bảo toàn e có 2nCl2 = 2nCu + 2nH2 Vì nCl2 = 4nH2 nên 2nCl2 = 2nCu + ½ nCl2 → nCu = ¾ . nCl2 → \(\frac{{{n_{CuS{O_4}}}}}{{{n_{KCl}}}} = \frac{3}{8}\) → \(\% CuS{O_4} = \frac{{3.160}}{{3.160 + 8.74,5}}.100\% = 44,61\% \) Câu 20 : Điện phân dung dịch X chứa a mol Cu(NO3)2 và 0,2 mol NaCl (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) trong thời gian t giây, thu được 3,36 lít khí ở anot( đktc) và dung dịch Y. Nếu thời gian điện phân là 2t giây thì tổng thể tích khí thu được ở cả 2 điện cực là 7,84 lít (đktc). Cho dung dịch Y phản ứng tối đa với m gam Fe tạo ra khí NO(sản phẩm khử duy nhất). Biết hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Giá trị của m là
Đáp án : B Phương pháp giải : Khi điện phân t giây thì nkhí(A) = 0,15 mol > ½ nCl nên khi này đã xảy ra cả điện phân nước Tại A : 2Cl- → Cl2 + 2e 2H2O → 4H+ + O2 + 4e => ne trao đổi = 2nCl2 + 4nO2 Khi điện phân 2t giây thì ne trao đổi Tại A : nCl2 = 0,1 và nO2 = ? Tại K : Cu+2 + 2e → Cu 2 H2O + 2e → 2OH- + H2 Số mol khí thoát ra ở cả hai cực là nkhí → nH2 Tại K thì ne trao đổi = 2nCu + 2nH2 => nCu = 0,3 mol => Dung dịch Y thu được sau điện phân t giây có Na+ : 0,2 mol; NO3- : ? và H+ : ? ; Cu2+ :? Y + Fe thì 3Fe + 8H+ +2NO3- → 3Fe+2 + 4H2O + 2NO Fe + Cu2+ → Fe2+ +Cu Lời giải chi tiết : Khi điện phân t giây thì nkhí(A) = 0,15 mol > ½ nCl nên khi này đã xảy ra cả điện phân nước Tại A : 2Cl- → Cl2 + 2e 2H2O → 4H+ + O2 + 4e Ta có nCl2 = ½ .nCl = 0,1 mol nên nO2 = nkhí - nCl2 = 0,15 -0,1 =0,05 mol => ne trao đổi = 2nCl2 + 4nO2 = 2.0,1 + 4.0,05 = 0,4 mol Khi điện phân 2t giây thì ne trao đổi = 0,4.2 = 0,8 mol Tại A : 2Cl- → Cl2 + 2e 2H2O → 4H+ + O2 + 4e Nên có 0,1 mol khí Cl2 và có 0,15 mol O2 Tại K : Cu+2 + 2e → Cu 2 H2O + 2e → 2OH- + H2 Số mol khí thoát ra ở cả hai cực là nkhí =7,84 : 22,4 = 0,35 = 0,1 + 0,15 + nH2 → nH2 = 0,1mol Tại K thì ne trao đổi = 0,8 = 2nCu + 2nH2 = 2nCu + 2.0,1 => nCu = 0,3 mol => a =0,3 mol => tại thời điểm t giây thì nCu(2+) bị điện phân = 0,4:2 =0,2 mol Dung dịch Y thu được sau điện phân t giây có Na+ : 0,2 mol; NO3- : 0,6 mol và H+ : 0,2 mol; Cu2+ :0,1 mol Y + Fe thì 3Fe + 8H+ +2NO3- → 3Fe+2 + 4H2O + 2NO => Phản ứng có H+ hết nên tính theo H+ => nFe phản ứng = 3/8 . nH+ = 3: 8 . 0,2 = 0,075 mol Fe + Cu2+ → Fe2+ +Cu => mFe = m = (0,075+0,1).56 = 9,8g Câu 21 : Hòa tan hoàn toàn m gam hỗn hợp gồm CuSO4 và FeCl3 vào nước dư thu được dung dịch X. Điện phân dung dịch X với điện cực trơ đến khi ở anot thoát ra 0,2 mol hỗn hợp khí có tỉ khối hơi so với H2 bằng 30,625 thì dừng lại. Dung dịch thu được sau điện phân có chứa 2 muối có nồng độ mol bằng nhau. Giả sử hiệu suất của quá trình điện phân là 100%, khí sinh ra không tan trong dung dịch. Giá trị của m là
Đáp án : B Phương pháp giải : Hai khí thoát ra ở anot là Cl2 và O2: Ta có hệ phương trình: \(\left\{ \begin{gathered}\sum {{n_{hh}} = {n_{C{l_2}}} + {n_{{O_2}}} = 0,2} \hfill \\\sum {{m_{hh}} = 71{n_{C{l_2}}} + 32{n_{{O_2}}} = 30,625.2.0,2} \hfill \\ \end{gathered} \right. \Rightarrow \left\{ \begin{gathered}{n_{C{l_2}}} = ? \hfill \\{n_{{O_2}}} = ? \hfill \\ \end{gathered} \right.\) Sau phản ứng thu được 2 muối có nồng độ bằng nhau → số mol 2 muối bằng nhau → Fe3+ điện phân hết, Cu2+ điện phân dư BTNT "Cl" → nFeCl3 = 2/3nCl2 = ? (mol) nCu2+ dư = nFe2+ = nFe3+ = ? Viết các bán phản ứng xảy ra ở mỗi điện cực, dùng bảo toàn e sẽ tính được mol Cu2+ điện phân BTNT "Cu": nCuSO4 = nCu2+ dư + nCu2+ điện phân Lời giải chi tiết : Hai khí thoát ra ở anot là Cl2 và O2: Ta có hệ phương trình: \(\left\{ \begin{gathered} Sau phản ứng thu được 2 muối có nồng độ bằng nhau → số mol 2 muối bằng nhau → Fe3+ điện phân hết, Cu2+ điện phân dư BTNT "Cl": 3nFeCl3 = 2nCl2 → nFeCl3 = 2/3. 0,15 = 0,1 (mol) → nCu2+ dư = nFe2+ = nFe3+ = 0,1 (mol) Đặt nCu2+ điện phân = a (mol)
BT e ta có: 0,1 + 2a = 0,3 + 0,2 → a = 0,2 (mol) BTNT "Cu": nCuSO4 = nCu2+ điện phân + nCu2+ dư = 0,2 + 0,1 = 0,3 (mol) → m = mCuSO4 + mFeCl3 = 0,3.160 + 0,1.162,5 = 64,25 (g) Câu 22 : Dung dịch hỗn hợp X gồm NaCl 0,6M và CuSO40,5M. Điện phân 100 ml dung dịch X (điện cực trơ, màng ngăn xốp, hiệu suất 100%, bỏ qua sự hòa tan của khí trong nước hay sự bay hơi của nước) với cường độ dòng điện không đổi 0,5A trong thời gian t giây. Dung dịch sau điện phân có khối lượng giảm 4,85 gam so với dung dịch ban đầu. Giá trị của t là
Đáp án : B Phương pháp giải : Ban đầu dung dịch X chứa \(n_{NaCl}=0,06 \;mol\) và \(n_{CuSO_4}=0,05 \;mol\) Tại A : 2Cl- → Cl2 + 2e Tại K thì Cu+2 +2e → Cu Tại thời điểm Cl- hết \(m_{dd \; giảm}=m_{Cl_2}+m_{Cu}\) \(=0,03.71+0,03.64=4,05<4,85\) nên tại A xảy ra điện phân nước Tại thời điểm Cu2+ bị điện phân hết thì \(m_{dd \; giảm}=m_{Cl_2}+m_{Cu}+m_{O_2}\) \(=0,03.71 + 0,05.64 +m_{O_2}=5,33+m_{O_2}>4,85\) Nên Cu2+ chưa điện phân hết Đặt \(n_{O_2}=x\) mol thì theo bảo toàn e có \(n_{Cu^{2+}}\) => lập phương trình mdd giảm tìm x Lời giải chi tiết : Ban đầu dung dịch X chứa \(n_{NaCl}=0,06\) mol và \(n_{CuSO_4}=0,05\) mol Tại A : 2Cl- → Cl2 + 2e Tại K thì Cu+2 +2e → Cu Vì nCl < 2nCu nên điện phân thì Cl- hết trước Tại thời điểm Cl- hết thì nCu = nCl : 2 = 0,06 : 2 =0,03 mol Khi đó mdd giảm = mCl2 + mCu = 0,03.71 + 0,03.64 = 4,05 g < 4,85 g nên tại A xảy ra điện phân nước \(2{H_2}O \to 4{H^ + } + {O_2} + 4e\) Tại thời điểm Cu2+ bị điện phân hết thì mdd giảm = mCl2 + mCu + mO2 = 0,03.71 + 0,05.64 + mO2 = 5,33 + mO2 > 4,85 Nên Cu2+ chưa điện phân hết Đặt nO2 = x mol thì theo bảo toàn e có \(n_{Cu^{2+}}=\dfrac{{(n_{Cl^-}+4n_{O_2})}}{2}=\dfrac{{(0,06+4x)}}{{2}}=0,03+2xmol\) Khối lượng dung dịch sau điện phân giảm là mdd giảm = mCu + mCl2 + mO2 = (0,03 + 2x).64 + 0,03.71 + 32x = 4,85 => x = 0,005 mol => nCu = 0,03 + 0,005.2 = 0,04 mol => ne trao đổi = 2nCu = \(\dfrac{{I.t}}{F} = \dfrac{{0,5.t}}{{96500}}\) = 2.0,04 =0,08 nên t = 15440 (s) Câu 23 : Điện phân dung dịch X chứa hỗn hợp gồm CuSO4 và NaCl (tỉ lệ mol tương ứng 1:3) với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi 2A. Sau thời gian điện phân t (giờ) thu được dung dịch Y (chứa 2 chất tan) có khối lượng giảm 12,45 gam so với dung dịch X. Dung dịch Y phản ứng vừa hết với 3,06 gam Al2O3. Bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước, hiệu suất điện phân 100%. Giá trị của t gần nhất với giá trị nào sau đây?
Đáp án : D Phương pháp giải : Gọi số mol của CuSO4, NaCl lần lượt là x và 3x (mol) Áp dụng định luật bảo toàn e, bảo toàn điện tích và bảo toàn khối lượng để giải bài toán Lời giải chi tiết : nCuSO4 = x(mol); nNaCl = 3x (mol) Dung dịch X chứa 2 chất tan gồm: Na+: 3x (mol); SO4 2-: x mol => nOH - = x mol Mặt khác nAl2O3 = 0,03 (mol) => nOH - = 2nAl2O3 = 0,06 (mol) Xét tại cực Catot: nCu = 0,06 mol; nH2 = a mol Anot: nCl2 = 0,09 mol; nO2 = b mol => 0,06 * 64 + 2a + 0,09 * 71 +32b = 12,45 (1) Áp dụng định luật bảo toàn điện tích: 2a - 4b = 0,06 (2) Từ (1) và (2) => a = 0,15; b = 0,06 => ne trao đổi = 0,42 (mol) => ne trao đổi= It/F => t = 5,63 h Câu 24 : Điện phân dung dịch X gồm 0,2 mol NaCl và a mol Cu(NO3)2 (với các điện cực trơ, màng ngăn xốp, cường độ dòng điện không thay đổi), thu được dung dịch Y có khối lượng giảm 17,5 gam so với khối lưọng của X. Cho m gam Fe vào Y đến khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Z, khí NO (sản phẩm khử duy nhất của N+5) và (m - 0,5) gam hỗn hợp kim loại. Giả thiết hiệu suất điện phân là 100%, nước bay hơi không đáng kể. Giá trị của a là
Đáp án : D Phương pháp giải : Biện luận các phản ứng xảy ra sau quá trình điện phân ở 2 cực Viết các bán phản ứng xảy ra tại catot và anot. Sử dụng bảo toàn e, bảo toàn nguyên tố để giải bài toán Lời giải chi tiết : Y + Fe sinh ra khí NO => Y chứa H+ => nước bị điện phân bên anot Y +Fe sinh ra hỗn hợp kim loại => Cu2+ còn dư * Anot: nCl2 = 0,1 mol; nO2 = x mol * Catot nCu = y mol Bảo toàn e ta có: 0,1 * 2 + 4x = 2y m giảm = 0,1 * 71 + 32x +64y = 17,5 => x = 0,025; y = 0,15 nH+ = 4nO2 = 0,1 (mol) => nNO = nH+/4 = 0,025 (mol) nCu2+ dư =z Bảo toàn electron: 2nFepứ=3nNO + 2nCu2+dư => nFepứ= z+ 0,0375 (mol) => m - 56*(z+0,0375)+64z = m -0,5 => z =0,2 Bảo toàn Cu => a = y +z = 0,35 (mol) Câu 25 : Điện phân 800 ml dung dịch gồm NaCl, HCl và CuCl2 0,02M (điện cực trơ, màng ngăn xốp) với cường độ dòng điện 9,65A. Mối liên hệ giữa thời gian điện phân và pH của dung dịch điện phân được biểu diễn bằng đồ thị dưới đây (giả sử muối đồng không bị thủy phân):
Giá trị của t trên đồ thị là
Đáp án : C Phương pháp giải : Từ đồ thị: Giai đoạn 1=> nHCl Giai đoạn 3 => nNaOH => Bảo toàn nguyên tố Cl- => ne trao đổi => t
Lời giải chi tiết : * Giai đoạn 1: pH = 2 => [H+] = 0,01 => nHCl = 0,008 (mol) * Giai đoạn 3: pH = 13 => [OH-] = 0,1 => nNaOH = 0,08 (mol) => nNaCl = 0,08 (mol) nCuCl2 = 0,08*0,02 = 0,016 (mol) => nCl- = 2 * nCuCl2 + nHCl + nNaOH = 0,12 (mol) Vì ở giai đoạn 3, nước đã bị điện phân bên catot (sinh ra OH-) nên bên anot chỉ có Cl- điện phân. => nCl- = ne trao đổi = 0,12 (mol) => ne trao đổi = It/F => t = 1200s Câu 26 : Điện phân dung dịch X chứa Cu(NO3)2 và NaCl với điện cực trơ. Tổng thể tích khí thoát ra ở cả 2 điện cực (V lít) phụ thuộc vào thời gian điện phân (t giây) theo đồ thị bên. Nếu điện phân X trong thời gian 3,5a giây thì thu được dung dịch có khối lượng giảm m gam so với dung dịch X. Giả thiết các chất điện phân ra không tan trong dung dịch. Giá trị của m là:
Đáp án : D Phương pháp giải : - Biện luận thành phần khí sinh ra ở mỗi đoạn. - Áp dụng định luật bảo toàn e, tăng giảm khối lượng để giải bài toán Lời giải chi tiết : Đoạn 1: Chỉ có khí Cl2 thoát ra. Đặt VCl2 = x (lít) Đoạn 2: Chỉ có khí O2 thoát ra. (do khí thoát ra nó thoải hơn so với đoạn 3) Mà ta thấy giá trị V lúc này gấp đôi đoạn tại thời điểm t = a (giây) Do đó VO2 = 2x - x = x (lít) Đoạn 3: Anot có O2 tiếp tục thoát ra. Còn ở catot có H2 thoát ra. Trong đoạn 3 này thời gian bằng nửa đoạn 2 nên VO2 = 0,5x (lít) Bảo toàn electron ta tính được VH2 = x (lít) Tổng cộng 3 đoạn thì khí thoát ra gồm Cl2 (x lít), O2 (1,5x lít) và H2 (x lít) Suy ra x + 1,5x + x = 7,84 → x = 2,24 lít Ban đầu: nNaCl =2.nCl2 = 0,2 mol Ta có: nCu(NO3)2 = nCu = nCl2 + 2.nO2 (đoạn 2) = 0,3 mol Tại thời điểm t = a (giây): ne trao đổi = 2nCl2 = 2.2,24 : 22,4 = 0,2 mol Tại thời điểm 3,5a (giây) (thuộc đoạn 3) ta có: ne trao đổi = 3,5. 0,2 = 0,7 mol Catot: Cu2+ + 2e → Cu 0,3 → 0,6 0,3 mol H2O + 2e → H2 + 2OH- 0,1 → 0,05 mol Anot: 2Cl- -2e → Cl2 0,2 0,2 0,1 mol 2H2O - 4e → O2 + 4H+ 0,5 0,125 mol Khi đó thu được 0,3 mol Cu ; 0,05 mol H2 ở catot và 0,1 mol Cl2 và 0,125 mol O2 ở anot. Khối lượng dung dịch giảm chính là khối lượng các chất thoát ra ở các điện cực. Do đó m = mCu + mH2 + mCl2 + mO2 = 0,3.64 + 0,05.2 + 0,1.71 + 0,125.32 = 30,4 (gam) Câu 27 : Điện phân (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) dung dịch X chứa a mol MSO4 (M là kim loại) và 0,3 mol KCl trong thời gian t giây, thu được 2,24 lít khí ở anot (đktc) và dung dịch Y có khối lượng giảm m gam so với khối lượng dung dịch X. Nếu thời gian điện phân là 2t giây thì thu được dung dịch Z có khối lượng giảm 19,6 gam so với khối lượng dung dịch X. Biết hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Phát biểu nào sau đây là đúng?
Đáp án : D Phương pháp giải : - Áp dụng bảo toàn nguyên tố Cl tính được tại anot: nCl2 max = 0,5.nKCl - Thời điểm t giây, ta so sánh nCl2 max với nkhí → Cl- chưa bị điện phân hết Tính được mol e trao đổi tại t giây - Thời điểm 1,4t giây, tính được mol e trao đổi và so sánh với mol Cl- ban đầu Lời giải chi tiết : Tại anot: nCl2 max = 0,5.nKCl = 0,15 mol - Thời điểm t giây, nCl2 max > nkhí = 0,1 mol → Cl- chưa bị điện phân hết Cl- → 0,5 Cl2 + 1e 0,2 ← 0,1 → 0,2 → ne(t) = 0,2 mol - Thời điểm 1,4t giây: ne(1,4t) = 1,4.ne(t) = 0,28 mol < nCl- = 0,3 mol → H2O chưa bị điện phân ở anot Câu 28 : Điện phân dung dịch chứa m gam hỗn hợp gồm Cu(NO3)2 và NaCl bằng điện cực trơ, màng ngăn xốp với cường độ dòng điện I = 5A, sau thời gian 6176 giây thì dừng điện phân. Để yên bình điện phân đến khi phản ứng xảy ra hoàn toàn, thu được 0,06 mol khí NO (sản phẩm khử duy nhất của N+5) và dung dịch X. Cho 400 ml dung dịch NaOH 1M vào X, lọc bỏ kết tủa, thu được dung dịch Y không màu. Cô cạn Y, lấy phần rắn đem nung đến khối lượng không đổi, thu được 29,64 gam chất rắn. Giá trị m là
Đáp án : A Lời giải chi tiết : \({n_e} = \frac{{It}}{F} = \frac{{5.6176}}{{96500}} = 0,32(mol)\) Đặt mol của Cu(NO3)2 và NaCl trong hỗn hợp đầu lần lượt là x, y (mol) - Do sinh ra khí NO nên có phản ứng của Cu với H+ và NO3- → Ở anot thì Cl- bị đp hết, H2O đang điện phân TH1: Ở catot H2O chưa bị điện phân Các quá trình điện phân tại các điện cực là: Catot: Cu2+ + 2e → Cu 0,16 ← 0,32 → 0,16 Anot: Cl- → 0,5 Cl2 + 1e H2O → 2H+ + 0,5 O2 + 2e - Xét phản ứng tạo NO: 3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O 0,09 ← 0,24 ← 0,06 ← 0,09 ← 0,06 (do nCu2+ > 0,16 mol → nNO3- > 0,32 mol → H+ hết) Dung dịch Y chứa: Cu2+ (x - 0,16 + 0,09 = x - 0,07); Na+ (y) ; NO3- (2x - 0,06) BTĐT → 2.(x - 0,07) + y = 2x - 0,06 → y = 0,08 - Cho 0,4 mol NaOH vào Y thu được dd không màu nên Cu2+ hết: +) Nếu chất rắn chỉ chứa: Na+; NO3- → nNa+ = 0,08 + 0,4 = 0,48 mol → Chất rắn sau khi nung chứa 0,48 mol NaNO2 → mNaNO2 = 0,48.69 = 33,12 gam ≠ 29,64 gam (loại) +) Chất rắn chứa: Na+ (0,48); NO3- (2x-0,06) và OH- BTĐT → nOH- = 0,54 - 2x (mol) Chất rắn sau nung chứa: Na+ (0,48) và NO2- (2x-0,06) và OH- (0,54-2x) → 23.0,48+ 46(2x-0,06) + 17(0,54-2x) = 29,64 → x = 0,21 Vậy m = 0,21.188 + 0,08.58,5 = 44,16 gam TH2: Ở catot H2O đã bị điện phân (HS tự xét) Câu 29 : Hòa tan hoàn toàn m gam hỗn hợp gồm CuSO4 và FeCl3 vào nước dư thu được dung dịch X. Điện phân dung dịch X với điện cực trơ đến khi ở anot thoát ra 0,2 mol hỗn hợp khí có tỉ khối hơi so với H2 bằng 30,625 thì dừng lại. Dung dịch thu được sau điện phân có chứa 2 muối có nồng độ mol bằng nhau. Giả sử hiệu suất của quá trình điện phân là 100%, khí sinh ra không tan trong dung dịch. Giá trị của m là
Đáp án : B Phương pháp giải : - Tính lượng khí Cl2, O2 sinh ra sau quá trình điện phân - Áp dụng định luật bảo toàn e, bảo toàn nguyên tố => nCuSO4 ban đầu => m Lời giải chi tiết : Khí tại anot gồm nCl2 = 0,15 mol; nO2 = 0,05 mol => Bảo toàn nguyên tố Cl => nFeCl3 = 0,1 mol => Dung dịch sau phản ứng có chứa Cu2+ và Fe2+ => Tại catot chỉ có chứa kim loại Cu =>Sau điện phân dung dịch gồm: nCuSO4 = nFeSO4 = 0,1 (mol) và H2SO4 = x (mol) Bảo toàn nguyên tố S => nCuSO4 (ban đầu) = nS = 0,2 +x => nCu ở catot = 0,1 + x (mol) Áp dụng định luật bảo toàn => nFe3+ + 2 * nCu (catot) = 2 nCl2 + 4nO2 => 0,1 + 2 * (0,1 +x) = 0,5 => x = 0,1 (mol) m = nCuSO4 (ban đầu) + nFeCl3 = 0,3 * 160 + 0,1 * 162,5 = 64,25 (gam) Câu 30 : Điện phân dung dịch X chứa m gam CuSO4 và 0,2 mol KCl (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi). Trong thời gian t giây, thu được 2,464 lít khí ở anot (đktc). Nếu thời gian điện phân là 2t giây thì tổng thể tích khí thu được ở cả hai điện cực là 5,824 lít (đktc). Biết hiệu suất điện phân là 100%, các khí sinh ra không tan trong dung dịch. Giá trị của m là:
Đáp án : B Phương pháp giải : Biện luận các chất khí có trong hỗn hợp khí thu được trong 2 giai đoạn: t và 2t giây => Xem H2O có bị điện phân ở các điện cực hay không - Dựa vào dịnh luật bảo toàn electron trao đổi => số mol Cu2+ => m Lời giải chi tiết : Các quá trình có thể xảy ra ở 2 điện cực: +) Catot: Cu2+ + 2e → Cu 2H2O + 2e → 2OH- + H2 +) Anot: 2Cl- → Cl2 + 2e 2H2O → 4H+ + O2 + 4e - Khi điện phân trong t giây: nkhí Anot = 2,464: 22,4 = 0,11 mol nCl2 = 0,5nCl- = 0,1 mol < 0,11 => Nước đã bị điện phân ở Anot => nO2 = nkhí anot – nCl2 = 0,11 – 0,1 = 0,01 mol => ne trao đổi = 2nCl2 + 4nO2 = 2.0,1 + 4.0,01 = 0,24 mol - Khi điện phân trong 2t giây: => Số mol electron trao đổi sẽ gấp đôi: ne trao đổi = 2.0,24 = 0,48 mol +) Tại Anot: nCl2 = 0,1 mol Có: ne = 2nCl2 + 4nO2 => nO2 = ¼ (0,48 – 2.0,1) = 0,07 mol => nkhí Anot = nCl2 + nO2 = 0,1 + 0,07 = 0,17 mol nkhí = 5,824: 22,4 = 0,26 mol > 0,17 => Nước bị điện phân ở Catot => nH2(Catot) = 0,26 – 0,17 = 0,09 mol - Bảo toàn e: ne trao đổi = 2nCu2+ + 2nH2 = 4nO2 + 2nCl2 => nCu2+ = ½ (4.0,07 + 2.0,1 – 2.0,09) = 0,15 mol => m = mCuSO4 = 160.0,15 = 24g Câu 31 : Điện phân dung dịch X chứa KCl, K2SO4, CuSO4 với điện cực trơ, màng ngăn xốp trong t giây thu được dung dịch Y; ở anot thu được 4,312 lít hỗn hợp khí (đktc); khối lượng catot tăng lên 16,64 gam. Cho dung dịch Y tác dụng với dung dịch Ba(OH)2 dư thu được 114,65 gam hỗn hợp kết tủa. Điện phân dung dịch X trong thời gian 2t giây thu được 10,808 lít khí (đktc) ở cả hai điện cực. Khối lượng chất tan trong dung dịch X là
Đáp án : D Phương pháp giải : Áp dụng định luật bảo toàn electron và bảo toàn điện tích để giải bài toán Lời giải chi tiết : *t giây: Do dung dịch Y tác dụng với Ba(OH)2 dư thu được hỗn hợp kết tủa (BaSO4 và Cu(OH)2) nên suy ra Y chứa Cu2+ => Cu2+ chưa bị điện phân hết. mCu = m catot tăng = 16,64 gam => nCu = 0,26 mol => ne(t) = 2nCu = 0,52 mol Đặt nCl2 = x và nO2 = y (mol) + n khí anot = x + y = 4,312/22,4 (1) + BTe: ne(t) = 2nCl2 + 4nO2 => 2x + 4y = 0,52 (2) Giải hệ (1) và (2) được x = 0,125 và y = 0,0675 BTNT "Cl" => nKCl = 2nCl2 = 0,25 mol Giả sử X chứa: KCl (0,25 mol); K2SO4 (a mol) và CuSO4 (b mol) Kết tủa gồm: Cu(OH)2 (b - 0,26) và BaSO4 (a + b) => m kết tủa = 98(b - 0,26) + 233(a + b) = 114,65 (*) *2t giây: ne(2t) = 2ne(t) = 1,04 mol nO2 = (ne(2t) - 2nCl2)/4 = (1,04 - 2.0,125)/4 = 0,1975 mol => nH2 = n khí 2 điện cực - nO2 - nCl2 = 0,4825 - 0,1975 - 0,125 = 0,16 mol BTe: ne(2t) = 2nCu + 2nH2 => 2b + 2.0,16 = 1,04 => b = 0,36 Thay b = 0,36 vào (*) suy ra a = 0,09 Vậy: m chất tan trong X = 0,25.74,5 + 0,09.174 + 0,36.160 = 91,885 gam
|