Trắc nghiệm Tổng hợp bài tập tính lượng chất dư, chất hết - Hóa học 8Đề bài Câu 1 : Sắt tác dụng với dung dịch CuSO4 theo phương trình: Fe + CuSO4 → FeSO4 + Cu. Nếu cho 11,2 gam sắt vào 40 gam CuSO4 thì sau phản ứng thu được khối lượng Cu là bao nhiêu?
Câu 2 : Cho sắt tác dụng với dung dịch axit H2SO4 theo sơ đồ sau: Fe + H2SO4 → FeSO4 + H2. Có 22,4 gam sắt tác dụng với 24,5 gam H2SO4. Thể tích khí H2 thu được ở đktc là
Câu 3 : Người ta cho 26 gam kẽm tác dụng với 49 gam H2SO4, sau phản ứng thu được muối ZnSO4, khí hiđro và chất còn dư. Khối lượng muối ZnSO4 thu được là
Câu 4 : Theo sơ đồ: Cu + O2 → CuO. Nếu cho 3,2 gam Cu tác dụng với 0,8 gam O2. Khối lượng CuO thu được là
Câu 5 : Cho 2,4 gam Mg vào dung dịch chứa 0,3 mol HCl. Tính thể tích khí H2 thu được ở điều kiện tiêu chuẩn. Biết phương trình hóa học của phản ứng là: Mg + 2HCl → MgCl2 + H2
Câu 6 : Cho 0,2 mol NaOH phản ứng với 0,2 mol H2SO4 thu được dung dịch A. Biết sơ đồ phản ứng: $NaOH + {H_2}S{O_4} \to N{a_2}S{O_4} + {H_2}O$. Tổng khối lượng chất tan trong A là
Câu 7 : Trộn dung dịch chứa 0,1 mol NaOH với dung dịch chứa 0,04 mol CuCl2 thu được NaCl và m gam kết tủa Cu(OH)2. Giá trị của m là
Câu 8 : Cho 15,3 gam Al2O3 tác dụng với dung dịch chứa 39,2 gam H2SO4, sản phẩm của phản ứng là Al2(SO4)3 và H2O. Tính khối lượng Al2(SO4)3 thu được.
Câu 9 : Đốt cháy hoàn toàn 0,2 mol Al trong khí Cl2 thu được 16,02 gam AlCl3. Số mol khí Cl2 đã phản ứng là
Câu 10 : Cho 112 gam Fe tác dụng hết với dung dịch axit clohiđric HCl tạo ra muối sắt (II) clorua FeCl2 và 4 gam khí hiđro H2. Khối lượng axit HCl đã tham gia phản ứng là:
Câu 11 : Cho 5,6 gam Fe phản ứng với 0,15 mol HCl theo phương trình: Fe + 2HCl \( \to\) FeCl2 + H2. Kết luận nào sau đây là chính xác:
Lời giải và đáp án Câu 1 : Sắt tác dụng với dung dịch CuSO4 theo phương trình: Fe + CuSO4 → FeSO4 + Cu. Nếu cho 11,2 gam sắt vào 40 gam CuSO4 thì sau phản ứng thu được khối lượng Cu là bao nhiêu?
Đáp án : B Phương pháp giải : +) Tính số mol Fe và số mol CuSO4 +) Viết PTHH +) So sánh tỉ lệ: $\dfrac{{{n_{F{\text{e}}}}}}{1}$ và $\dfrac{{{n_{CuS{O_4}}}}}{1}$ => chất hết, chất dư => tính khối lượng Cu theo chất hết Lời giải chi tiết : Số mol Fe là: ${n_{F{\text{e}}}} = \dfrac{{11,2}}{{56}} = 0,2\,mol$ Số mol CuSO4 là: ${n_{CuS{O_4}}} = \dfrac{m}{M} = \dfrac{{40}}{{64 + 32 + 16.4}} = 0,25\,mol$ PTHH: Fe + CuSO4 → FeSO4 + Cu Xét tỉ lệ: $\dfrac{{{n_{F{\text{e}}}}}}{1} = \dfrac{{0,2}}{1} = 0,2$ và $\dfrac{{{n_{CuS{O_4}}}}}{1} = \dfrac{{0,25}}{1} = 0,25$ Vì 0,2 < 0,25 => Fe phản ứng hết, CuSO4 dư => tính khối lượng Cu theo Fe PTHH: Fe + CuSO4 → FeSO4 + Cu 1mol 1mol 0,2 mol → 0,2 mol => khối lượng Cu thu được sau phản ứng là: mCu = 0,2.64 = 12,8 gam Câu 2 : Cho sắt tác dụng với dung dịch axit H2SO4 theo sơ đồ sau: Fe + H2SO4 → FeSO4 + H2. Có 22,4 gam sắt tác dụng với 24,5 gam H2SO4. Thể tích khí H2 thu được ở đktc là
Đáp án : A Phương pháp giải : +) Tính số mol Fe và số mol H2SO4 +) Viết PTHH +) Xét tỉ lệ: $\dfrac{{{n_{F{\text{e}}}}}}{1}$ và $\dfrac{{{n_{{H_2}S{O_4}}}}}{1}$ => chất dư và chất hết => tính số mol H2 theo chất hết Lời giải chi tiết : Số mol Fe là: ${n_{F{\text{e}}}} = \dfrac{{22,4}}{{56}} = 0,4\,mol$ Số mol H2SO4 là: ${n_{{H_2}S{O_4}}} = \dfrac{m}{M} = \dfrac{{24,5}}{{2 + 32 + 16.4}} = 0,25\,mol$ PTHH: Fe + H2SO4 → FeSO4 + H2 Xét tỉ lệ: $\dfrac{{{n_{F{\text{e}}}}}}{1} = \dfrac{{0,4}}{1} = 0,4$ và $\dfrac{{{n_{{H_2}S{O_4}}}}}{1} = \dfrac{{0,25}}{1} = 0,25$ Vì 0,25 < 0,4 => Fe dư, H2SO4 phản ứng hết => tính số mol H2 theo H2SO4 PTHH: Fe + H2SO4 → FeSO4 + H2 1mol 1mol 0,25 mol → 0,25 mol => Thể tích khí H2 thu được ở đktc là: V = 22,4.n = 22,4.0,25 = 5,6 lít Câu 3 : Người ta cho 26 gam kẽm tác dụng với 49 gam H2SO4, sau phản ứng thu được muối ZnSO4, khí hiđro và chất còn dư. Khối lượng muối ZnSO4 thu được là
Đáp án : D Phương pháp giải : +) Tính số mol Zn và số mol H2SO4 +) Viết PTHH +) Xét tỉ lệ: $\dfrac{{{n_{Zn}}}}{1} = \dfrac{{0,4}}{1}$ và $\dfrac{{{n_{{H_2}S{O_4}}}}}{1} = \dfrac{{0,5}}{1}$ => chất hết, chất dư => phản ứng tính theo chất hết Lời giải chi tiết : Số mol Zn là: ${n_{Zn}} = \dfrac{{26}}{{65}} = 0,4\,mol$ Số mol H2SO4 là: ${n_{{H_2}S{O_4}}} = \dfrac{{49}}{{98}} = 0,5\,mol$ PTHH: Zn + H2SO4 → ZnSO4 + H2 Xét tỉ lệ: $\dfrac{{{n_{Zn}}}}{1} = \dfrac{{0,4}}{1} = 0,4$ và $\dfrac{{{n_{{H_2}S{O_4}}}}}{1} = \dfrac{{0,5}}{1} = 0,5$ Vì 0,4 < 0,5 => Zn phản ứng hết, H2SO4 dư => phản ứng tính theo Zn PTHH: Zn + H2SO4 → ZnSO4 + H2 1mol 1mol 0,4mol → 0,4mol => Khối lượng muối ZnSO4 thu được là: ${m_{Zn{\text{S}}{O_4}}} = 0,4.161 = 64,4\,gam$ Câu 4 : Theo sơ đồ: Cu + O2 → CuO. Nếu cho 3,2 gam Cu tác dụng với 0,8 gam O2. Khối lượng CuO thu được là
Đáp án : D Phương pháp giải : +) Tính số mol Cu và số mol O2 +) Xét tỉ lệ: $\dfrac{{{n_{Cu}}}}{2}$ và $\dfrac{{{n_{{O_2}}}}}{1}$ => chất dư thừa hoặc vừa đủ, phản ứng tính theo chất phản ứng hết Lời giải chi tiết : Số mol Cu là: ${n_{Cu}} = \dfrac{{3,2}}{{64}} = 0,05\,mol$ Số mol O2 là: ${n_{{O_2}}} = \dfrac{{0,8}}{{32}} = 0,025\,mol$ PTHH: 2Cu + O2 → 2CuO Xét tỉ lệ: $\dfrac{{{n_{Cu}}}}{2} = \dfrac{{0,05}}{2} = 0,025$ và $\dfrac{{{n_{{O_2}}}}}{1} = \dfrac{{0,025}}{1} = 0,025$ Vì tỉ lệ $\dfrac{{{n_{Cu}}}}{2} = \dfrac{{{n_{{O_2}}}}}{1}$ => phản ứng vừa đủ => tính theo Cu hoặc O2 đều được PTHH: 2Cu + O2 → 2CuO 2mol 2mol 0,05mol → 0,05mol => khối lượng CuO thu được là: mCuO = 0,05.80 = 4 gam Cách 2: Vì các chất đều phản ứng vừa đủ => áp dụng định luật bảo toàn khối lượng ta có: ${m_{CuO}} = {m_{Cu}} + {m_{{O_2}}} = 3,2 + 0,8 = 4\,gam$ Câu 5 : Cho 2,4 gam Mg vào dung dịch chứa 0,3 mol HCl. Tính thể tích khí H2 thu được ở điều kiện tiêu chuẩn. Biết phương trình hóa học của phản ứng là: Mg + 2HCl → MgCl2 + H2
Đáp án : A Phương pháp giải : +) Tính số mol Mg +) Viết PTHH +) Xét tỉ lệ: $\dfrac{{{n_{Mg}}}}{1}$ và $\dfrac{{{n_{HCl}}}}{2}$ => chất dư, chất hết => tính H2 theo chất hết Lời giải chi tiết : Số mol Mg là: ${n_{Mg}} = \dfrac{{2,4}}{{24}} = 0,1(mol)$ PTHH: Mg + 2HCl → MgCl2 + H2 Xét tỉ lệ: $\dfrac{{{n_{Mg}}}}{1} = \dfrac{{0,1}}{1} = 0,1$ và $\dfrac{{{n_{HCl}}}}{2} = \dfrac{{0,3}}{2} = 0,15$ Vì 0,1 < 0,15 => Mg phản ứng hết, HCl dư => phản ứng tính theo Mg 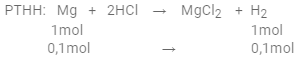 $ = > {V_{{H_2}}} = 0,1.22,4 = 2,24(l)$ Câu 6 : Cho 0,2 mol NaOH phản ứng với 0,2 mol H2SO4 thu được dung dịch A. Biết sơ đồ phản ứng: $NaOH + {H_2}S{O_4} \to N{a_2}S{O_4} + {H_2}O$. Tổng khối lượng chất tan trong A là
Đáp án : C Phương pháp giải : +) Viết PTHH +) Xét tỉ lệ: $\frac{{{n_{NaOH}}}}{2}$ và $\frac{{{n_{{H_2}S{O_4}}}}}{1}$ => chất phản ứng hết, chất dư => tính sản phẩm theo chất hết +) khối lượng chất tan trong A = khối lượng chất dư + khối lượng Na2SO4 Lời giải chi tiết : PTHH: $2NaOH + {H_2}S{O_4} \to N{a_2}S{O_4} + 2{H_2}O$ Xét tỉ lệ: $\frac{{{n_{NaOH}}}}{2} = \frac{{0,2}}{2} = 0,1$ và $\frac{{{n_{{H_2}S{O_4}}}}}{1} = \frac{{0,2}}{1} = 0,2$ Vì 0,1 < 0,2 => NaOH phản ứng hết, H2SO4 còn dư => phản ứng tính theo NaOH PTHH: $2NaOH + {H_2}S{O_4} \to N{a_2}S{O_4} + 2{H_2}O$ Tỉ lệ PT: 2 1 1 Ban đầu: 0,2 0,2 0 (mol) Phản ứng 0,2 0,1 0,1 (mol) Sau pư: 0 0,1 0,1 (mol) dung dich A có: $\left\{ \begin{gathered}N{a_2}S{O_4}:0,1(mol) \hfill \\{H_2}S{O_4}du:0,1(mol) \hfill \\ \end{gathered} \right.$ => tổng khối lượng chất tan trong A là: 14,2 + 9,8 = 24 gam Câu 7 : Trộn dung dịch chứa 0,1 mol NaOH với dung dịch chứa 0,04 mol CuCl2 thu được NaCl và m gam kết tủa Cu(OH)2. Giá trị của m là
Đáp án : A Phương pháp giải : +) Viết PTHH Lời giải chi tiết : PTHH: $2NaOH + CuC{l_2} \to Cu{(OH)_2} \downarrow + 2NaCl$ Xét tỉ lệ: $\frac{{{n_{NaOH}}}}{2} = \frac{{0,1}}{2} = 0,05$ và $\frac{{{n_{CuC{l_2}}}}}{1} = \frac{{0,04}}{1} = 0,04$ Vì 0,05 > 0,04 => NaOH dư, CuCl2 phản ứng hết => tính số mol kết tủa theo CuCl2 PTHH: $2NaOH + CuC{l_2} \to Cu{(OH)_2} \downarrow + 2NaCl$ Tỉ lệ PT: 1mol 1mol Pư: 0,04 → 0,04 mol $\Rightarrow {m_{Cu{{(OH)}_2}}} = 0,04.98 = 3,92\,gam$ Câu 8 : Cho 15,3 gam Al2O3 tác dụng với dung dịch chứa 39,2 gam H2SO4, sản phẩm của phản ứng là Al2(SO4)3 và H2O. Tính khối lượng Al2(SO4)3 thu được.
Đáp án : C Phương pháp giải : +) Tính số mol Al2O3 và số mol H2SO4 +) Viết PTHH +) Xét tỉ lệ: $\dfrac{{{n_{A{l_2}{O_3}}}}}{1}$ và $\dfrac{{{n_{{H_2}S{O_4}}}}}{3}$ => xác định chất hết, chất dư => tính số mol Al2(SO4)3 theo chất hết Lời giải chi tiết : Số mol Al2O3 là: ${n_{A{l_2}{O_3}}} = \dfrac{{15,3}}{{102}} = 0,15\,mol$ Số mol H2SO4 là: ${n_{{H_2}S{O_4}}} = \dfrac{{39,2}}{{98}} = 0,4\,mol$ PTHH: Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O Xét tỉ lệ: $\dfrac{{{n_{A{l_2}{O_3}}}}}{1} = \dfrac{{0,15}}{1} = 0,15$ và $\dfrac{{{n_{{H_2}S{O_4}}}}}{3} = \dfrac{{0,4}}{3} = 0,133$ Vì 0,133 < 0,15 => Al2O3 dư, H2SO4 phản ứng hết => tính số mol Al2(SO4)3 theo H2SO4 PTHH: Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O Tỉ lệ PT: 3mol 1mol Phản ứng: 0,4mol → $\dfrac{{0,4}}{3}$ mol => Khối lượng Al2(SO4)3 thu được là: $\dfrac{{0,4}}{3}.342 = 45,6\,gam$ Câu 9 : Đốt cháy hoàn toàn 0,2 mol Al trong khí Cl2 thu được 16,02 gam AlCl3. Số mol khí Cl2 đã phản ứng là
Đáp án : A Phương pháp giải : Đầu bài cho số mol của chất tham gia và số mol của sản phẩm => lập PTHH và tính theo sản phẩm Lời giải chi tiết : Số mol AlCl3 là: ${n_{AlC{l_3}}} = \frac{{16,02}}{{133,5}} = 0,12\,mol$ Vì đầu bài cho số mol của chất tham gia và số mol của sản phẩm => tính toán theo số mol sản phẩm PTHH: 2Al + 3Cl2 $\xrightarrow{{{t^o}}}$ 2AlCl3 Tỉ lệ PT: 3 mol 2 mol Phản ứng: 0,18 mol ← 0,12 mol => số mol khí Cl2 phản ứng là 0,18 mol Câu 10 : Cho 112 gam Fe tác dụng hết với dung dịch axit clohiđric HCl tạo ra muối sắt (II) clorua FeCl2 và 4 gam khí hiđro H2. Khối lượng axit HCl đã tham gia phản ứng là:
Đáp án : A Phương pháp giải : Đầu bài cho số mol của chất tham gia và số mol của sản phẩm => lập PTHH và tính theo sản phẩm Lời giải chi tiết : Vì đầu bài cho số mol của chất tham gia và số mol của sản phẩm => tính toán theo số mol sản phẩm Số mol khí H2 là: ${n_{{H_2}}} = \frac{4}{2} = 2\,mol$ PTHH: Fe + 2HCl → FeCl2 + H2 Tỉ lệ PT: 2mol 1mol Phản ứng: 4mol ← 2mol => Khối lượng HCl đã phản ứng là: mHCl = 4.36,5 = 146 gam Câu 11 : Cho 5,6 gam Fe phản ứng với 0,15 mol HCl theo phương trình: Fe + 2HCl \( \to\) FeCl2 + H2. Kết luận nào sau đây là chính xác:
Đáp án : B Phương pháp giải : Tính số mol Fe : nFe = mFe : MFe = ? (mol) Dựa vào phương trình so sánh xem Fe và HCl chất nào phản ứng hết. Lời giải chi tiết : nFe = 5,6 : 56 = 0,1 (mol) Fe + 2HCl \( \to\) FeCl2 + H2 Theo phương trình 1 2 (mol) Theo đề bài: 0,1 0,15 (mol) Ta thấy : \(\dfrac{{0,1}}{1} > \dfrac{{0,15}}{2}\). Do vậy HCl là chất phản ứng hết, Fe là chất còn dư.
|












