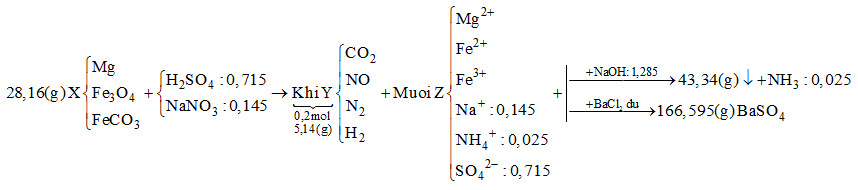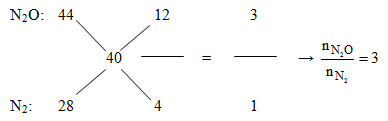Trắc nghiệm Tổng hợp bài tập tính oxi hóa của HNO3 - Hóa 11Đề bài Câu 1 : Tổng hệ số cân bằng của các chất trong phản ứng dưới đây là : Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O
Câu 2 : Cho sơ đồ phản ứng : FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO + H2O Sau khi cân bằng, hệ số cân bằng của HNO3 trong phản ứng là :
Câu 3 : Tỉ lệ số phân tử HNO3 đóng vai trò chất oxi hóa và môi trường trong phản ứng sau là : FeO + HNO3 → Fe(NO3)3 + NO + H2O
Câu 4 : Cho sơ đồ phản ứng : Al + HNO3 → Al(NO3)3 + N2 + N2O + H2O Biết khi cân bằng tỉ lệ số mol giữa N2O và N2 là 3 : 2. Tỉ lệ mol nAl : nN2O : nN2 lần lượt là
Câu 5 : Cho 0,05 mol Mg phản ứng vừa đủ với HNO3 giải phóng ra V lít khí N2 (đktc, là sản phẩm khử duy nhất). Giá trị của V là
Câu 6 : Cho 19,2 gam kim loại M tan trong dung dịch HNO3 dư được 4,48 lít NO (đktc, là sản phẩm khử duy nhất). M là
Câu 7 : Hoà tan hết 5,4 gam kim loại M trong HNO3 dư được 8,96 lít khí đktc gồm NO và NO2, dX/H2 = 21. Tìm M biết rằng N+2 và N+4 là sản phẩm khử của N+5
Câu 8 : Cho 11 gam hỗn hợp gồm Al và Fe vào dung dịch HNO3 dư được 6,72 lít NO (đktc, là sản phẩm khử duy nhất). Khối lượng của Al và Fe lần lượt là
Câu 9 : Hoà tan hết m gam Al vào dung dịch HNO3 dư được 0,01 mol NO và 0,015 mol N2O là các sản phẩm khử của N+5. Giá trị của m là
Câu 10 : Cho 6,4 gam Cu tan vừa đủ trong 200ml dung dịch HNO3 thu được khí X gồm NO và NO2, dX/H2 = 18 (không còn sản phẩm khử nào khác của N+5). Nồng độ mol/lít của dung dịch HNO3 đã dùng là
Câu 11 : Cho 1,35 gam hỗn hợp gồm Cu, Mg, Al tác dụng hết với dung dịch HNO3 thu được hỗn hợp khí gồm 0,01 mol NO và 0,04 mol NO2 (không còn sản phẩm khử nào khác của N+5). Khối lượng muối trong dung dịch là
Câu 12 : Hòa tan hoàn toàn 8,9 gam hỗn hợp gồm Mg và Zn bằng lượng vừa đủ 500 ml dung dịch HNO3 1M. Sau khi các phản ứng kết thúc, thu được 1,008 lít khí N2O (đktc, khí duy nhất) và dung dịch X chứa m gam muối. Giá trị của m là
Câu 13 : Hoà tan hết hỗn hợp X gồm Zn và ZnO trong dung dịch HNO3 loãng dư thấy không có khí bay ra và trong dung dịch chứa 113,4 gam Zn(NO3)2 và 8 gam NH4NO3. Phần trăm khối lượng Zn trong X là
Câu 14 : Cho hỗn hợp gồm 6,72 gam Mg và 0,8 gam MgO tác dụng hết với lượng dư dung dịch HNO3. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,896 lít một khí X (đktc) và dung dịch Y. Làm bay hơi dung dịch Y thu được 46 gam muối khan. Khí X là
Câu 15 : Cho 20,88 gam FexOy phản ứng với dung dịch HNO3 dư được 0,672 lít khí B (đktc, là sản phẩm khử duy nhất) và dung dịch X. Trong dung dịch X có 65,34 gam muối. Oxit của sắt và khí B là
Câu 16 : Hoà tan đến phản ứng hoàn toàn 0,1 mol FeS2 vào HNO3 đặc nóng dư. Thể tích NO2 bay ra (ở đktc, biết rằng N+4 là sản phẩm khử duy nhất của N+5) là
Câu 17 : Cho 19,2 gam Cu phản ứng với 500 ml dung dịch NaNO3 1M và 500 ml HCl 2M. Tính thể tích khí NO thoát ra (đktc) biết NO là sản phẩm khử duy nhất của N+5 :
Câu 18 : Cho 4,8 gam S tan hết trong 100 gam HNO3 63% thu được NO2 (sản phẩm khử duy nhất, khí duy nhất) và dung dịch X. Dung dịch X có thể hoà tan hết tối đa bao nhiêu gam Cu (biết sản phẩm khử sinh ra là NO2) ?
Câu 19 : Cho 2 thí nghiệm sau: Thí nghiệm 1: Cho 6,4 gam Cu phản ứng với 120 ml dung dịch HNO3 1M được a lít NO. Thí nghiệm 2: Cho 6,4 gam Cu phản ứng với 120 ml dung dịch HNO3 1M và H2SO4 0,5M được b lít NO. Biết NO là sản phẩm khử duy nhất của N+5. Mối liên hệ giữa a và b là
Câu 20 : Cho 29 gam hỗn hợp gồm Al, Cu và Ag tác dụng vừa đủ với 950 ml dung dịch HNO3 1,5M, thu được dung dịch chứa m gam muối và 5,6 lít hỗn hợp khí X (đktc) gồm NO và N2O. Tỉ khối của X so với H2 là 16,4. Giá trị của m là
Câu 21 : Hòa tan hoàn toàn m gam Al bằng 620 ml dung dịch HNO3 1M vừa đủ thu được hỗn hợp khí X ( gồm hai khí) và dung dịch Y chứa 8m gam muối. Cho dung dịch NaOH dư vào Y thấy có 25,84 gam NaOH phản ứng. Hai khí trong X là cặp khí nào sau đây
Câu 22 : Cho 21,6 gam bột Mg tan hết trong dung dịch hỗn hợp gồm NaNO3 và NaHSO4 thu được dung dịch X chỉ chứa m gam hỗn hợp muối trung hòa và 5,6 lít hỗn hợp khí Y gồm N2O và H2( tỉ khối của Y so với H2 là 13,6). Giá trị gần nhất của m là
Câu 23 : Hòa tan hết 28,16 gam hỗn hợp rắn X gồm Mg, Fe3O4 và FeCO3 vào dung dịch chứa H2SO4 và NaNO3, thu được 4,48 lít (đktc) hỗn hợp khí Y (gồm CO2, NO, N2, H2) có khối lượng 5,14 gam và dung dịch Z chỉ chứa các muối trung hòa. Dung dịch Z phản ứng tối đa với 1,285 mol NaOH, thu được 43,34 gam kết tủa và 0,56 lít khí (đktc). Mặt khác, cho dung dịch Z tác dụng với lượng dư dung dịch BaCl2 thu được 166,595 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng Mg trong X là
Câu 24 : Dung dịch X chứa 0,2 mol Fe(NO3)3 và 0,24 mol HCl. Dung dịch X có thể hòa tan được tối đa bao nhiêu gam Cu (biết phản ứng tạo khí NO là sản phẩm khử duy nhất)
Câu 25 : Cho hỗn hợp X chứa 18,6 gam gồm Fe, Al, Mg, FeO, Fe3O4 và CuO. Hòa tan hết trong dung dịch HNO3 dư thấy có 0,98 mol HNO3 tham gia phản ứng thu được 68,88 gam muối và 2,24 lít (đktc) khí NO duy nhất. Mặt khác, từ hỗn hợp X ta có thể điều chế được tối đa m gam kim loại. Giá trị của m là
Câu 26 : Hỗn hợp X gồm Al và Fe có tỉ lệ số mol tương ứng là 1:1. Cho 2,49 gam X vào dung dịch chứa 0,17 mol HCl, thu được dung dịch Y. Cho 200 ml dung dịch AgNO3 1M vào Y, thu được khí NO và m gam chất rắn. Biết các phản ứng xảy ra hoàn toàn, NO là sản phẩm khử duy nhất của N+5. Giá trị của m gần nhất với giá trị nào sau đây
Câu 27 : HNO3 chỉ thể hiện tính oxi hóa khi tác dụng với các chất thuộc dãy nào dưới đây?
Câu 28 : Cho m gam hỗn hợp G gồm Mg và Al có tỉ lệ mol 4 : 5 vào dung dịch HNO3 20%. Sau khi các kim loại tan hết có 6,72 lít hỗn hợp X gồm NO, N2O, N2 bay ra (đktc) và được dung dịch T. Thêm một lượng O2 vừa đủ vào X, sau phản ứng được hỗn hợp khí Y. Dẫn Y từ từ qua dung dịch KOH dư, có 4,48 lít hỗn hợp khí Z đi ra (đktc). Tỉ khối của Z đối với H2 bằng 20. Nếu cho dung dịch NaOH vào dung dịch T thì lượng kết tủa lớn nhất thu được là (m + 39,1) gam. Biết HNO3 dùng dư 20% so với lượng cần thiết. Nồng độ phần trăm của Al(NO3)3 trong T gần nhất với
Câu 29 : HNO3 chỉ thể hiện tính axit khi tác dụng với các chất thuộc dãy nào dưới đây?
Câu 30 : Cho m gam hỗn hợp X (gồm Mg, Al, Zn và Cu) tác dụng hết với dung dịch HNO3 thu được dung dịch Y (không có muối amoni) và 11,2 lít (đktc) hỗn hợp khí Z (gồm N2, NO, N2O và NO2, trong đó N2 và NO2 có phần trăm thể tích bằng nhau) có tỉ khối đối với heli bằng 8,9. Số mol HNO3 phản ứng là
Câu 31 : Cho 20 gam Fe tác dụng với HNO3 loãng thu được sản phẩm khử duy nhất NO. Sau khi phản ứng xảy ra hoàn toàn còn dư 3,2 gam Fe. Thể tích NO thu được ở đktc là :
Câu 32 : Cho hỗn hợp gồm 0,1 mol CuO và 0,1 mol Cu tác dụng với dung dịch HNO3 đặc nóng, dư thu được V lít khí NO2 (đktc). Giá trị của V là
Câu 33 : Hòa tan hết 30 gam chất rắn gồm Mg, MgO, MgCO3 trong dung dịch HNO3 thấy có 2,15 mol HNO3 phản ứng. Sau phản ứng thu được 4,48 lít (đktc) hỗn hợp khí NO, CO2 có tỉ khối so với H2 là 18,5 và dung dịch X chứa m gam muối. Giá trị m là
Câu 34 : Hỗn hợp X gồm a mol P và b mol S. Hoà tan hoàn toàn X trong dung dịch HNO3 đặc, nóng lấy dư 20% so với lượng cần phản ứng thu được dung dịch Y và thoát ra khí NO2 (sản phẩm khử duy nhất). Trung hoà dung dịch Y bằng NaOH thì cần bao nhiêu mol?
Lời giải và đáp án Câu 1 : Tổng hệ số cân bằng của các chất trong phản ứng dưới đây là : Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O
Đáp án : A Phương pháp giải : Xem lại lí thuyết cân bằng phản ứng Lời giải chi tiết : $\begin{align}& {{\overset{+8/3}{\mathop{Fe}}\,}_{3}}{{O}_{4}}+\text{ }H\overset{+5}{\mathop{N}}\,{{O}_{3}}\xrightarrow{{}}\overset{+3}{\mathop{Fe}}\,{{\left( N{{O}_{3}} \right)}_{3}}+\text{ }\overset{+2}{\mathop{N}}\,O\text{ }+\text{ }{{H}_{2}}O \\ & 3.|3\overset{+8/3}{\mathop{Fe\,}}\,\,\to \,\,3\overset{+3}{\mathop{Fe}}\,\,\,+1e \\ & 1.|\overset{+5}{\mathop{N}}\,\,\,+\,\,3e\,\,\to \,\,\overset{+2}{\mathop{N}}\,O \\ \end{align}$ => phương trình phản ứng: 3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O => tổng hệ số cân bằng là: 3 + 28 + 9 + 1 + 14 = 55 Câu 2 : Cho sơ đồ phản ứng : FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO + H2O Sau khi cân bằng, hệ số cân bằng của HNO3 trong phản ứng là :
Đáp án : D Phương pháp giải : +) Coi Fe và S trogn 1 chất có tổng số oxi hóa là 0 +) Xác định các nguyên tố có số oxi hóa thay đổi +) Viết quá trình cho - nhận e => xác định hệ số cân bằng Lời giải chi tiết : Coi Fe và S ban đầu có trong chất có số oxi hóa là 0 $\begin{align}& {{\overset{0}{\mathop{FeS}}\,}_{2}}+\text{ }H\overset{+5}{\mathop{N}}\,{{O}_{3}}\xrightarrow{{}}\overset{+3}{\mathop{Fe}}\,{{\left( N{{O}_{3}} \right)}_{3}}+\text{ }{{H}_{2}}\overset{+6}{\mathop{S}}\,{{O}_{4}}+\text{ }\overset{+2}{\mathop{N}}\,O\text{ }+\text{ }{{H}_{2}}O \\ & \,\,1.|{{\overset{0}{\mathop{FeS}}\,}_{2}}\to \,\,\overset{+3}{\mathop{Fe}}\,\,\,+\,\,2\overset{+6}{\mathop{S}}\,\,\,+\,\,15e \\ & 5.|\overset{+5}{\mathop{N}}\,\,+\,\,3e\,\,\to \,\,\overset{+2}{\mathop{N}}\, \\ \end{align}$ => PTHH: FeS2 + 8HNO3 → Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O => hệ số của HNO3 là 8 Câu 3 : Tỉ lệ số phân tử HNO3 đóng vai trò chất oxi hóa và môi trường trong phản ứng sau là : FeO + HNO3 → Fe(NO3)3 + NO + H2O
Đáp án : C Phương pháp giải : Xem lại lí thuyết cân bằng phản ứng Lời giải chi tiết : $\begin{align}& \overset{+2}{\mathop{Fe}}\,O\text{ }+\text{ }H\overset{+5}{\mathop{N}}\,{{O}_{3~}}\xrightarrow{{}}\overset{+3}{\mathop{Fe}}\,{{\left( N{{O}_{3}} \right)}_{3}}+\text{ }\overset{+2}{\mathop{N}}\,O\text{ }+\text{ }{{H}_{2}}O \\ & 3.|\overset{+2}{\mathop{Fe}}\,\,\,\to \,\,\overset{+3}{\mathop{Fe}}\,\,\,+\,\,1e \\ & 1.|\overset{+5}{\mathop{N}}\,\,\,+\,\,3e\,\,\to \,\,\overset{+2}{\mathop{N}}\, \\ \end{align}$ => PTHH: 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O => trong 10 phân tử HNO3 phản ứng, có 1 phân tử là chất oxi hóa tạo NO, 9 phân tử làm môi trường tạo muối Fe(NO3)3 Câu 4 : Cho sơ đồ phản ứng : Al + HNO3 → Al(NO3)3 + N2 + N2O + H2O Biết khi cân bằng tỉ lệ số mol giữa N2O và N2 là 3 : 2. Tỉ lệ mol nAl : nN2O : nN2 lần lượt là
Đáp án : D Phương pháp giải : Xem lại lí thuyết cân bằng phản ứng Lời giải chi tiết : $\begin{align}& \overset{0}{\mathop{Al\text{ }}}\,+\text{ }H\overset{+5}{\mathop{N}}\,{{O}_{3}}\xrightarrow{{}}\overset{+3}{\mathop{Al}}\,{{\left( N{{O}_{3}} \right)}_{3}}+\text{ }{{\overset{0}{\mathop{N}}\,}_{2}}+\text{ }{{\overset{+1}{\mathop{N}}\,}_{2}}O\text{ }+\text{ }{{H}_{2}}O \\ & 44.|\overset{0}{\mathop{Al}}\,\,\,\to \,\,\overset{+3}{\mathop{Al}}\,\,\,+\,3e \\ &3.|10\overset{+5}{\mathop{N}}\,\,\,+\,44e\,\,\to \,\,{{\overset{+1}{\mathop{3N}}\,}_{2}}O\,\,+\,\,2{{\overset{0}{\mathop{N}}\,}_{2}} \\ \end{align}$ => PTHH: 44Al + 162HNO3 → 44Al(NO3)3 + 6N2 + 9N2O + 81H2O Câu 5 : Cho 0,05 mol Mg phản ứng vừa đủ với HNO3 giải phóng ra V lít khí N2 (đktc, là sản phẩm khử duy nhất). Giá trị của V là
Đáp án : C Phương pháp giải : Sử dụng bảo toàn e: 2.nMg = 10.nN2 Lời giải chi tiết : Quá trình cho – nhận e: $\overset{0}{\mathop{Mg}}\,\to \overset{+2}{\mathop{Mg}}\,\,+\,2e~~~~~~\,\,\,\,\,\,\,\,~~~2\overset{+5}{\mathop{N}}\,\,\,+\text{ }10e\to {{\overset{0}{\mathop{\,N}}\,}_{2}}$ 0,05 → 0,1 0,1 → 0,01 => V = 0,01.22,4 = 0,224 lít Câu 6 : Cho 19,2 gam kim loại M tan trong dung dịch HNO3 dư được 4,48 lít NO (đktc, là sản phẩm khử duy nhất). M là
Đáp án : B Phương pháp giải : +) Viết quá trình cho - nhận e và sử dụng bảo toàn e => mối liên hệ M và n Lời giải chi tiết : nNO = 0,2 mol Quá trình cho – nhận e: $\overset{0}{\mathop{M}}\,\to \overset{+n}{\mathop{M}}\,\,+\,ne~~~~~~\,\,\,\,\,\,\,\,~~~\overset{+5}{\mathop{N}}\,\,\,+\text{ 3}e\to \overset{+2}{\mathop{\,N}}\,O$ $\frac{0,6}{n}$ ← 0,6 0,6 ← 0,2 $=>\,\,\frac{19,2}{M}=\frac{0,6}{n}\,\,=>\,\,M=32n$ Với n = 2 => M = 64 => M là Cu Câu 7 : Hoà tan hết 5,4 gam kim loại M trong HNO3 dư được 8,96 lít khí đktc gồm NO và NO2, dX/H2 = 21. Tìm M biết rằng N+2 và N+4 là sản phẩm khử của N+5
Đáp án : B Phương pháp giải : Gọi nNO = x mol; nNO2 = y mol => nhỗn hợp khí = PT(1) $\bar{M}=\frac{30x+46y}{x+y}=21.2$ => PT(2) +) Viết quá trình cho – nhận e và áp dụng bảo toàn e: ne cho = ne nhận = 3.nNO + nNO2 => mối liên hệ M và n Lời giải chi tiết : Gọi nNO = x mol; nNO2 = y mol => nhỗn hợp khí = x + y = 0,4 mol (1) $\bar{M}=\frac{30x+46y}{x+y}=21.2$ (2) Từ (1) và (2) => x = 0,1; y = 0,3 Quá trình cho – nhận e: $\begin{align}& \overset{0}{\mathop{M}}\,\to \overset{+n}{\mathop{M}}\,\,+\,ne;\,\,\,\,\,\,\,\,\overset{+5}{\mathop{N}}\,\,\,+\text{ 3}e\to \overset{+2}{\mathop{\,N}}\,O \\ & \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\overset{+5}{\mathop{N}}\,\,\,+\text{ 1}e\to \overset{+4} {\mathop{\,N}}\,{{O}_{2}} \\ \end{align}$ Bảo toàn e: ne cho = ne nhận = 3.nNO + nNO2 = 0,6 $=>\,\,\frac{5,4}{M}.n=0,6\,\,=>\,\,M=9n$ Với n = 3 => M = 27 => M là Al Câu 8 : Cho 11 gam hỗn hợp gồm Al và Fe vào dung dịch HNO3 dư được 6,72 lít NO (đktc, là sản phẩm khử duy nhất). Khối lượng của Al và Fe lần lượt là
Đáp án : B Phương pháp giải : +) Quá trình cho – nhận e: $\begin{align}& Al\to \overset{+3}{\mathop{Al}}\,\,\,\,+\,\,\,3e~~~~~~\,\,\,\,\,\,\,\,~~\overset{+5}{\mathop{N}}\,\,\,+\text{ 3}e\to \overset{+2}{\mathop{\,N}}\,O \\ & Fe\,\to \overset{+3}{\mathop{\,Fe}}\,\,\,+\,\,\,3e \\ \end{align}$ +) Bảo toàn e: 3.nAl + 3.nFe = 3.nNO Lời giải chi tiết : Gọi số mol của Al và Fe lần lượt là x và y mol => mhỗn hợp = 27x + 56y = 11 (1) Quá trình cho – nhận e: \(\begin{align}& Al\to \overset{+3}{\mathop{Al}}\,\,\,\,+\,\,\,3e~~~~~~\,\,\,\,\,\,\,\,~~\overset{+5}{\mathop{N}}\,\,\,+\text{ 3}e\to \overset{+2}{\mathop{\,N}}\,O \\ & Fe\,\to \overset{+3}{\mathop{\,Fe}}\,\,\,+\,\,\,3e \\ \end{align}\) Bảo toàn e: 3.nAl + 3.nFe = 3.nNO => x + y = 0,3 (2) Từ (1) và (2) => x = 0,2; y = 0,1 => mAl = 0,2.27 = 5,4 gam; mFe = 0,1.56 = 5,6 gam Câu 9 : Hoà tan hết m gam Al vào dung dịch HNO3 dư được 0,01 mol NO và 0,015 mol N2O là các sản phẩm khử của N+5. Giá trị của m là
Đáp án : C Phương pháp giải : Sử dụng bảo toàn e: 3.nAl = 3.nNO + 8.nN2O Lời giải chi tiết : Xét quá trình cho – nhận e: $\begin{align}& Al\to \overset{+3}{\mathop{Al}}\,\,+\,3e~~~~~~\,\,\,\,\,~~\overset{+5}{\mathop{N}}\,\,\,+\text{ 3}e\to \overset{+2}{\mathop{\,N}}\,O \\ & \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\overset{+5}{\mathop{2N}}\,\,\,+\text{ 8}e\to \overset{+1}{\mathop{\,{{N}_{2}}}}\,O \\ \end{align}$ Bảo toàn e: 3.nAl = 3.nNO + 8.nN2O => nAl = (3.0,01 + 8.0,015) / 3 = 0,05 mol => m = 0,05.27 = 1,35 gam Câu 10 : Cho 6,4 gam Cu tan vừa đủ trong 200ml dung dịch HNO3 thu được khí X gồm NO và NO2, dX/H2 = 18 (không còn sản phẩm khử nào khác của N+5). Nồng độ mol/lít của dung dịch HNO3 đã dùng là
Đáp án : D Phương pháp giải : Xét quá trình cho – nhận e: $\begin{align}& Cu\to \overset{+2}{\mathop{Cu}}\,\,+\,2e~~~~~~\,\,\,\,~~\overset{+5}{\mathop{N}}\,\,\,+\text{ 3}e\to \overset{+2}{\mathop{\,N}}\,O \\ & \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\overset{+5}{\mathop{N}}\,\,\,+\text{ 1}e\to \overset{+4}{\mathop{\,N}}\,{{O}_{2}} \\ \end{align}$ +) Bảo toàn e: 2.nCu = 3.nNO + nNO2 +) Bảo toàn nguyên tố N: nHNO3 phản ứng = nNO3 (trong muối) + nNO + nNO2 Lời giải chi tiết : nCu = 0,1 mol Gọi số mol của NO và NO2 lần lượt là x và y mol Xét quá trình cho – nhận e: $\begin{align}& Cu\to \overset{+2}{\mathop{Cu}}\,\,+\,2e~~~~~~\,\,\,\,~~\overset{+5}{\mathop{N}}\,\,\,+\text{ 3}e\to \overset{+2}{\mathop{\,N}}\,O \\ & \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\overset{+5}{\mathop{N}}\,\,\,+\text{ 1}e\to \overset{+4}{\mathop{\,N}}\,{{O}_{2}} \\ \end{align}$ Bảo toàn e: 2.nCu = 3.nNO + nNO2 => 3x + y = 0,2 (1) \({\bar M_X} = \dfrac{{30x + 46y}}{{x + y}} = 18.2\,\,\,\,(2)\) Từ (1) và (2) => x = 1/18 mol; y = 1/30 mol Bảo toàn nguyên tố N: nHNO3 phản ứng = nNO3 (trong muối) + nNO + nNO2 = 0,1.2 + 1/18 + 1/30 = 13/45 mol => CM HNO3 = 13/9 M Câu 11 : Cho 1,35 gam hỗn hợp gồm Cu, Mg, Al tác dụng hết với dung dịch HNO3 thu được hỗn hợp khí gồm 0,01 mol NO và 0,04 mol NO2 (không còn sản phẩm khử nào khác của N+5). Khối lượng muối trong dung dịch là
Đáp án : C Phương pháp giải : +) Bảo toàn e: ne cho = ne nhận = 3.nNO + nNO2 +) nNO3 (trong muối) = ne cho +) mmuối = mkim loại + mNO3 Lời giải chi tiết : Bảo toàn e: ne cho = ne nhận = 3.nNO + nNO2 = 3.0,01 + 0,04 = 0,07 mol => nNO3 (trong muối) = ne cho = 0,07 mol => mmuối = mkim loại + mNO3 = 1,35 + 0,07.62 = 5,69 gam Câu 12 : Hòa tan hoàn toàn 8,9 gam hỗn hợp gồm Mg và Zn bằng lượng vừa đủ 500 ml dung dịch HNO3 1M. Sau khi các phản ứng kết thúc, thu được 1,008 lít khí N2O (đktc, khí duy nhất) và dung dịch X chứa m gam muối. Giá trị của m là
Đáp án : B Phương pháp giải : Gọi số mol của Mg và Zn lần lượt là x và y mol Giả sử trong X chứa muối NH4NO3 (a mol) Xét quá trình cho – nhận e: $\begin{align}& Mg\to \overset{+2}{\mathop{Mg}}\,\,+\,2e~~~~~~\,\,\,\,\,\,\,\,~~\overset{+5}{\mathop{2N}}\,\,\,+\text{ 8}e\to {{\overset{+1}{\mathop{\,N}}\,}_{2}}O \\ & Zn\to \overset{+2}{\mathop{Zn}}\,\,+\,2e\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\overset{+5}{\mathop{N}}\,\,\,+8e\to \overset{-3}{\mathop{\,N}}\,{{H}_{4}} \\ \end{align}$ +) Bảo toàn e: 2.nMg + 2.nZn = 8.nN2O + 8.nNH4NO3 +) nNO3 (trong muối) = ne cho +) Bảo toàn nguyên tố N: nHNO3 = nNO3 (trong muối) + 2.nN2O + 2.nNH4NO3 +) mmuối = mkim loại + mNO3 (trong muối KL) + mNH4NO3 Lời giải chi tiết : nN2O = 0,045 mol Gọi số mol của Mg và Zn lần lượt là x và y mol => mhỗn hợp = 24x + 65y = 8,9 (1) Giả sử trong X chứa muối NH4NO3 (a mol) Xét quá trình cho – nhận e: $\begin{align}& Mg\to \overset{+2}{\mathop{Mg}}\,\,+\,2e~~~~~~\,\,\,\,\,\,\,\,~~\overset{+5}{\mathop{2N}}\,\,\,+\text{ 8}e\to {{\overset{+1}{\mathop{\,N}}\,}_{2}}O \\ & Zn\to \overset{+2}{\mathop{Zn}}\,\,+\,2e\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\overset{+5}{\mathop{N}}\,\,\,+8e\to \overset{-3}{\mathop{\,N}}\,{{H}_{4}} \\ \end{align}$ Bảo toàn e: 2.nMg + 2.nZn = 8.nN2O + 8.nNH4NO3 => 2x + 2y = 0,36 + 8a (2) nNO3 (trong muối) = ne cho = 2x + 2y mol Bảo toàn nguyên tố N: nHNO3 = nNO3 (trong muối) + 2.nN2O + 2.nNH4NO3 => 0,5 = 2x + 2y + 2.0,045 + 2a (3) Từ (1), (2) và (3) => x = 0,1; y = 0,1; a = 0,005 => mmuối = mkim loại + mNO3 (trong muối KL) + mNH4NO3 = 8,9 + 62.(2.0,1 + 2.0,1) + 80.0,005 = 34,1 gam Câu 13 : Hoà tan hết hỗn hợp X gồm Zn và ZnO trong dung dịch HNO3 loãng dư thấy không có khí bay ra và trong dung dịch chứa 113,4 gam Zn(NO3)2 và 8 gam NH4NO3. Phần trăm khối lượng Zn trong X là
Đáp án : C Phương pháp giải : ZnO tác dụng với HNO3 không sinh ra sản phẩm khử vì đã đạt số oxi hóa tối đa +) Bảo toàn e: 2.nZn = 8.nNH4NO3 +) Bảo toàn nguyên tố Zn: nZn(NO3)2 = nZn + nZnO Lời giải chi tiết : nZn(NO3)2 = 0,6 mol; nNH4NO3 = 0,1 mol ZnO tác dụng với HNO3 không sinh ra sản phẩm khử vì đã đạt số oxi hóa tối đa Bảo toàn e: 2.nZn = 8.nNH4NO3 => nZn = 4.0,1 = 0,4 mol Bảo toàn nguyên tố Zn: nZn(NO3)2 = nZn + nZnO => nZnO = 0,6 – 0,4 = 0,2 mol \( = > \,\,\% {m_{Zn}} = \frac{{0,4.65}}{{0,4.65 + 0,2.81}}.100\% = 61,61\% \) Câu 14 : Cho hỗn hợp gồm 6,72 gam Mg và 0,8 gam MgO tác dụng hết với lượng dư dung dịch HNO3. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,896 lít một khí X (đktc) và dung dịch Y. Làm bay hơi dung dịch Y thu được 46 gam muối khan. Khí X là
Đáp án : B Phương pháp giải : +) nMg(NO3)2 = nMg + nMgO => mMg(NO3)2 < 46 => muối khan chứa Mg(NO3)2 và NH4NO3 Quá trình cho – nhận e: $\begin{align}& \overset{0}{\mathop{M}}\,g\to \overset{+2}{\mathop{Mg}}\,\,+\,2e~~~~~~\,\,\,~~\overset{+5}{\mathop{N}}\,\,\,+\text{ n}e\to X \\ & \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\overset{+5}{\mathop{N}}\,\,\,+\text{ 8}e\to \overset{-3}{\mathop{\,N}}\,{{H}_{4}} \\ \end{align}$ Bảo toàn e: 2.nMg = n.nX + 8.nNH4NO3 Lời giải chi tiết : nMg = 0,28 mol; nMgO = 0,02 mol MgO tác dụng với HNO3 không sinh ra sản phẩm khử vì đã đạt số oxi hóa tối đa Ta có: nMg(NO3)2 = nMg + nMgO = 0,28 + 0,02 = 0,3 mol => mMg(NO3)2 = 44,4 gam < 46 => muối khan chứa Mg(NO3)2 và NH4NO3 => nNH4NO3 = 0,02 mol Quá trình cho – nhận e: $\begin{align}& \overset{0}{\mathop{M}}\,g\to \overset{+2}{\mathop{Mg}}\,\,+\,2e~~~~~~\,\,\,~~\overset{+5}{\mathop{N}}\,\,\,+\text{ n}e\to X \\ & \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\overset{+5}{\mathop{N}}\,\,\,+\text{ 8}e\to \overset{-3}{\mathop{\,N}}\,{{H}_{4}} \\ \end{align}$ Bảo toàn e: 2.nMg = n.nX + 8.nNH4NO3 => 2.0,28 = 0,04.n + 8.0,02 => n = 10 => X là N2 Câu 15 : Cho 20,88 gam FexOy phản ứng với dung dịch HNO3 dư được 0,672 lít khí B (đktc, là sản phẩm khử duy nhất) và dung dịch X. Trong dung dịch X có 65,34 gam muối. Oxit của sắt và khí B là
Đáp án : B Phương pháp giải : +) Coi hỗn hợp ban đầu gồm Fe và O +) Bảo toàn nguyên tố Fe: nFe(NO3)3 = nFe +) => mO = moxit - mFe +) Xét quá trình cho – nhận e: $\begin{align}& Fe\to \overset{+3}{\mathop{Fe}}\,\,+\,3e~~~~~~\,\,\,~~\overset{+5}{\mathop{\,\,N}}\,\,\,+\text{ n}e\to X \\ & \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\overset{0}{\mathop{O}}\,\,\,+\text{ 2}e\to \overset{-2}{\mathop{O}}\, \\ \end{align}$ +) Bảo toàn e: 3.nFe = n.nX + 2.nO Lời giải chi tiết : Muối thu được là Fe(NO3)3 0,27 mol Coi hỗn hợp ban đầu gồm Fe và O Bảo toàn nguyên tố Fe: nFe(NO3)3 = nFe = 0,27 mol => mO = 20,88 – 0,27.56 = 5,76 gam => nO = 0,36 mol => nFe : nO = 0,27 : 0,36 = 3 : 4 => oxit sắt là Fe3O4 Xét quá trình cho – nhận e: $\begin{align}& Fe\to \overset{+3}{\mathop{Fe}}\,\,+\,3e~~~~~~\,\,\,\,~~\overset{+5}{\mathop{\,\,N}}\,\,\,+\text{ n}e\to X \\ & \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\overset{0}{\mathop{O}}\,\,\,+\text{ 2}e\to \overset{-2}{\mathop{O}}\, \\ \end{align}$ Bảo toàn e: 3.nFe = n.nX + 2.nO => 3.0,27 = n.0,03 + 2.0,36 => n = 3 => X là NO Câu 16 : Hoà tan đến phản ứng hoàn toàn 0,1 mol FeS2 vào HNO3 đặc nóng dư. Thể tích NO2 bay ra (ở đktc, biết rằng N+4 là sản phẩm khử duy nhất của N+5) là
Đáp án : C Phương pháp giải : Xét quá trình cho - nhận e: $F\text{e}{{S}_{2}}\to \overset{+3}{\mathop{F\text{e}}}\,+2\overset{+6}{\mathop{\text{S}}}\,+15\text{e}$ $\overset{+5}{\mathop{N}}\,+1\text{e}\to \overset{+4}{\mathop{N}}\,{{O}_{2}}$ +) Sử dụng bảo toàn e => tính số mol NO2 Lời giải chi tiết : Xét quá trình cho – nhận e: $\begin{align}& Fe{{S}_{2}}\to \,\,F{{e}^{3+}}+\,\,2\overset{+6}{\mathop{S}}\,\,\,+\,\,15e\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\overset{+5}{\mathop{N}}\,\,\,+\,\,1e\,\,\to \,\,\overset{+4}{\mathop{N}}\,{{O}_{2}} \\ & 0,1\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\to \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,1,5\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,1,5\,\,\,\,\to \,\,\,\,1,5 \\ \end{align}$ => VNO2 = 1,5.22,4 = 33,6 lít Câu 17 : Cho 19,2 gam Cu phản ứng với 500 ml dung dịch NaNO3 1M và 500 ml HCl 2M. Tính thể tích khí NO thoát ra (đktc) biết NO là sản phẩm khử duy nhất của N+5 :
Đáp án : B Phương pháp giải : 3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O +) Xét tỉ lệ các chất và ion => phản ứng tính theo chất hết +) nNO = 2/3.nCu => VNO Lời giải chi tiết : nCu = 0,3 mol; nNaNO3 = 0,5 mol; nHCl = 1 mol 3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O Xét \(\dfrac{{{n_{Cu}}}}{3} = \dfrac{{0,3}}{3} = 0,1;\,\,\,\,\dfrac{{{n_{{H^ + }}}}}{8} = \dfrac{1}{8} = 0,125;\,\,\,\,\dfrac{{{n_{NO_3^ - }}}}{2} = \dfrac{{0,5}}{2} = 0,25\) => Cu hết, H+ và NO3- còn dư => nNO = 2/3.nCu = 0,2 mol => VNO = 4,48 lít Câu 18 : Cho 4,8 gam S tan hết trong 100 gam HNO3 63% thu được NO2 (sản phẩm khử duy nhất, khí duy nhất) và dung dịch X. Dung dịch X có thể hoà tan hết tối đa bao nhiêu gam Cu (biết sản phẩm khử sinh ra là NO2) ?
Đáp án : A Phương pháp giải : - Tính số mol S, HNO3 - Xác định các chất có trong dd X S + 6HNO3 → 6NO2 + H2SO4 + 2H2O => dung dịch sau phản ứng gồm H2SO4 và HNO3 - Tính nH+ và nNO3- - Tính mCu Cu + 4H+ + 2NO3- → Cu2+ + 2NO2 + 2H2O => mCu Lời giải chi tiết : - nS = 0,15 mol; nHNO3 = 1 mol S + 6HNO3 → 6NO2 + H2SO4 + 2H2O 0,15 → 0,9 → 0,15 => dung dịch sau phản ứng gồm H2SO4 0,15 mol và HNO3 0,1 mol => nH+ = 0,4 mol; nNO3- = 0,1 mol - Cu + 4H+ + 2NO3- → Cu2+ + 2NO2 + 2H2O 0,05 ← 0,2 ← 0,1 => mCu = 3,2 gam Câu 19 : Cho 2 thí nghiệm sau: Thí nghiệm 1: Cho 6,4 gam Cu phản ứng với 120 ml dung dịch HNO3 1M được a lít NO. Thí nghiệm 2: Cho 6,4 gam Cu phản ứng với 120 ml dung dịch HNO3 1M và H2SO4 0,5M được b lít NO. Biết NO là sản phẩm khử duy nhất của N+5. Mối liên hệ giữa a và b là
Đáp án : B Phương pháp giải : 3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O TN1: Xét các tỉ lệ: \(\frac{{{n_{Cu}}}}{3} ;\,\,\,\,\frac{{{n_{{H^ + }}}}}{8} ;\frac{{{n_{NO_3^ - }}}}{2} \) => H+ hết, Cu và NO3- dư => phản ứng tính theo H+ TN2: Xét các tỉ lệ: \(\frac{{{n_{Cu}}}}{3};\,\,\,\,\frac{{{n_{{H^ + }}}}}{8} ;\,\,\,\,\frac{{{n_{NO_3^ - }}}}{2} \) => H+ hết, Cu và NO3- dư => phản ứng tính theo H+ Lời giải chi tiết : 3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O TN1: nCu = 0,1 mol; nHNO3 = 0,12 mol Xét \(\frac{{{n_{Cu}}}}{3} = \frac{{0,1}}{3};\,\,\,\,\frac{{{n_{{H^ + }}}}}{8} = \frac{{0,12}}{8} = 0,015;\,\,\,\,\frac{{{n_{NO_3^ - }}}}{2} = \frac{{0,12}}{2} = 0,06\) => H+ hết, Cu và NO3- dư => phản ứng tính theo H+ nNO (1) = 1/4.nH+ = 1/4.0,12 = 0,03 mol TN2: nCu = 0,1 mol; nH+ = 0,24 mol; nNO3- = 0,12 mol Xét \(\frac{{{n_{Cu}}}}{3} = \frac{{0,1}}{3};\,\,\,\,\frac{{{n_{{H^ + }}}}}{8} = \frac{{0,24}}{8} = 0,03;\,\,\,\,\frac{{{n_{NO_3^ - }}}}{2} = \frac{{0,12}}{2} = 0,06\) => H+ hết, Cu và NO3- dư => phản ứng tính theo H+ nNO (2) = 1/4.nH+ = 1/4.0,24 = 0,06 mol => nNO (2) = 2.nNO (1) => b = 2a Câu 20 : Cho 29 gam hỗn hợp gồm Al, Cu và Ag tác dụng vừa đủ với 950 ml dung dịch HNO3 1,5M, thu được dung dịch chứa m gam muối và 5,6 lít hỗn hợp khí X (đktc) gồm NO và N2O. Tỉ khối của X so với H2 là 16,4. Giá trị của m là
Đáp án : A Phương pháp giải : +) Gọi nNO = a mol; nN2O = b mol => nX = PT(1) \({\bar M_X} => PT\) (2) +) Giả sử phản ứng tạo ra NH4NO3 x mol +) Bảo toàn e: ne cho = ne nhận = 3.nNO + 8.nN2O + 8.nNH4NO3 +) Bảo toàn nguyên tố N: nHNO3 = nNO + 2.nN2O + nNO3 (trong muối) + 2.nNH4NO3 +) mmuối = mkim loại + mNO3 (trong muối) + mNH4NO3 Lời giải chi tiết : Gọi nNO = a mol; nN2O = b mol => nX = a + b = 0,25 mol (1) \({\bar M_X} = \frac{{30a + 44b}}{{a + b}} = 16,4.2\) (2) Từ (1) và (2) => a = 0,2; b = 0,05 Giả sử phản ứng tạo ra NH4NO3 x mol Bảo toàn e: ne cho = ne nhận = 3.nNO + 8.nN2O + 8.nNH4NO3 = 3.0,2 + 8.0,05 + 8a => nNO3 (trong muối) = ne cho = 1 + 8a Bảo toàn nguyên tố N: nHNO3 = nNO + 2.nN2O + nNO3 (trong muối) + 2.nNH4NO3 => 1,425 = 0,2 + 2.0,05 + 1 + 8a + 2a => a = 0,0125 mol => mmuối = mkim loại + mNO3 (trong muối) + mNH4NO3 = 29 + (1 + 8.0,0125).62 + 0,0125.80 = 98,2 gam Câu 21 : Hòa tan hoàn toàn m gam Al bằng 620 ml dung dịch HNO3 1M vừa đủ thu được hỗn hợp khí X ( gồm hai khí) và dung dịch Y chứa 8m gam muối. Cho dung dịch NaOH dư vào Y thấy có 25,84 gam NaOH phản ứng. Hai khí trong X là cặp khí nào sau đây
Đáp án : C Phương pháp giải : Al + 0,62 mol HNO3 → Al(NO3)3 + khí X Nếu muối chỉ có mAl(NO3)3 = \(\frac{m}{{27}}.213 = 7,89m\) < 8m → muối có cả NH4NO3 Al(NO3)3 + 4NaOH → NaAlO2 + NaNO3 + 2H2O NH4NO3 + NaOH → NaNO3 + NH3 + H2O → nNaOH → m → nAl và nNH4NO3 Đặt số oxi hóa trung bình của N trong khí là x Al → Al+3 + 3e N+5 +8e → N-3 N+5 + (5-x) e → N+x Bảo toàn e có Bảo toàn N có → x Lời giải chi tiết : Al + 0,62 mol HNO3 → Al(NO3)3 + khí X Nếu muối chỉ có mAl(NO3)3 = < 8m → muối có cả NH4NO3 Al(NO3)3 + 4NaOH → NaAlO2 + NaNO3 + 2H2O NH4NO3 + NaOH → NaNO3 + NH3 + H2O Ta có nNaOH = 0,646 = \(\dfrac{m}{{27}}.4 + \dfrac{{8m - 7,89m}}{{80}}\) → m =4,32 g → Al: 0,16 mol và NH4NO3: 0,006 mol Al → Al+3 + 3e N+5 +8e → N-3 N+5 + (5-x) e → N+X Bảo toàn e có 3.nAl = 8nNH4 + (5-x).nN(+x) → 0,48 = 8.0,006 + (5-x).nN(+x) Bảo toàn N có nN(+x) + 2nNH4NO3 + 3nAl = nHNO3 → nN(+x) = 0,62 – 2.0,006 – 3.0,16 = 0,128 → x = 1,625 A sai vì cả 2 khí N đều có số oxh > 1,625 B sai vì tạo khí H2 C đúng D sai vì cả 2 khí đều có số oxh nhỏ hơn 1,625 Câu 22 : Cho 21,6 gam bột Mg tan hết trong dung dịch hỗn hợp gồm NaNO3 và NaHSO4 thu được dung dịch X chỉ chứa m gam hỗn hợp muối trung hòa và 5,6 lít hỗn hợp khí Y gồm N2O và H2( tỉ khối của Y so với H2 là 13,6). Giá trị gần nhất của m là
Đáp án : C Phương pháp giải : Xét hỗn hợp khí Y có N2O : x mol và H2 : y mol Có nY = x + y mol và mY = MY . nY = 44a + 2y => giải được x và y Xét phản ứng Mg tác dụng với NaNO3 và NaHSO4 thì 4Mg + 10H+ + 2NO3- → 4Mg+2 + 5H2O + N2O Mg +2H+ → Mg+2 + H2 So sánh 4nN2O + nH2 với nMg nếu nhỏ hơn thì phản ứng có tạo ra NH4+ : 4Mg + 10H+ + NO3- → 4Mg+2 + 3H2O + NH4+ Bảo toàn nguyên tố N có nNaNO3 Bảo toàn nguyên tố H có nNaHSO4 => các ion trong X => mmuối = mion Lời giải chi tiết : Xét hỗn hợp khí Y có N2O : x mol và H2 : y mol Có nY = 0,25 = x + y mol Và mY = MY . nY = 13,6.2.0,25 = 6,8 g = 44x + 2y Nên x = 0,15 mol và y = 0,1 mol Xét phản ứng Mg tác dụng với NaNO3 và NaHSO4 thì 4Mg + 10H+ + 2NO3- → 4Mg+2 + 5H2O + N2O Mg +2H+ → Mg+2 + H2 Ta có 4nN2O + nH2 = 4.0,15 + 0,1 = 0,7 mol < nMg = 0,9 nên phản ứng có tạo ra NH4+ : 4Mg + 10H+ + NO3- → 4Mg+2 + 3H2O + NH4+ nên nNH4+ = (0,9 – 0,7 ) : 4 =0,05 mol Bảo toàn nguyên tố N có nNaNO3 = 2nN2O + nNH4 =2.0,15 + 0,05 = 0,35 mol Bảo toàn nguyên tố H có nNaHSO4 = 10nN2O + 2nH2 + 10nNH4 = 10.0,15 + 0,1.2 + 0,05.10 = 2,2 mol Sau phản ứng dung dịch X thu được có Mg+2 : 0,9 mol; NH4+ : 0,05 mol; Na+ : 2,55 mol và SO42- : 2,2 mol => mmuối = mion = 0,9.24 + 0,05.18 + 2,55.23 + 2,2.96 = 292,35
Câu 23 : Hòa tan hết 28,16 gam hỗn hợp rắn X gồm Mg, Fe3O4 và FeCO3 vào dung dịch chứa H2SO4 và NaNO3, thu được 4,48 lít (đktc) hỗn hợp khí Y (gồm CO2, NO, N2, H2) có khối lượng 5,14 gam và dung dịch Z chỉ chứa các muối trung hòa. Dung dịch Z phản ứng tối đa với 1,285 mol NaOH, thu được 43,34 gam kết tủa và 0,56 lít khí (đktc). Mặt khác, cho dung dịch Z tác dụng với lượng dư dung dịch BaCl2 thu được 166,595 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng Mg trong X là
Đáp án : A Phương pháp giải : Bảo toàn khối lượng, bảo toàn nguyên tố, bảo toàn điện tích. Lời giải chi tiết : Khi cho dung dịch Z tác dụng với BaCl2 dư thì kết tủa thu được là BaSO4 \( \to {n_{BaS{O_4}}} = \dfrac{{166,595}}{{233}} = 0,715\,\,mol\) Bảo toàn gốc \(SO_4^{2 - } \to {n_{{H_2}S{O_4}}} = 0,715\,\,mol\) Khi cho Z tác dụng với NaOH vừa đủ thu được khí là NH3 \({n_{N{H_3}}} = \dfrac{{0,56}}{{22,4}} = 0,025\,\,mol \to {n_{NH_4^ + }} = 0,025\,\,mol\) Bảo toàn điện tích cho dung dịch Z: \(2{n_{M{g^{2 + }}}} + 2{n_{F{e^{2 + }}}} + 3{n_{F{e^{3 + }}}} + {n_{NH_4^ + }} + {n_{N{a^ + }}} = 2{n_{SO_4^{2 - }}}\) Mà \({n_{NaOH}} = 2{n_{M{g^{2 + }}}} + 2{n_{F{e^{2 + }}}} + 3{n_{F{e^{3 + }}}} + {n_{NH_4^ + }} = 1,285\,\,mol\) \( \to 1,285 + {n_{N{a^ + }}} = 2.0,715 \to {n_{N{a^ + }}} = 0,145\,\,mol\)
Ta có: \({n_{O{H^ - }\,\,(trong\,\,hidroxit)}} + {n_{NH_4^ + }} = {n_{NaOH}} \to {n_{O{H^ - }\,\,(trong\,\,hidroxit)}} = 1,285 - 0,025 = 1,26\,\,mol\) Bảo toàn khối lượng: \({m_{Fe}} + {m_{Mg}} + {m_{O{H^ - }\,\,(trong\,\,hidroxit)}} = 43,34 \to {m_{Fe}} + {m_{Mg}} + 1,26.17 = 43,34\) \( \to {m_{Fe}} + {m_{Mg}} = 21,92g\) Bảo toàn khối lượng cho dung dịch Z: \({m_{Mg}} + {m_{Fe}} + {m_{Na}} + {m_{NH_4^ + }} + {m_{SO_4^{2 - }}} = 21,92 + 0,145.23 + 0,025.18 + 0,715.96 = 94,345g\) Bảo toàn khối lượng cho phản ứng: \({m_X} + {m_{{H_2}S{O_4}}} + {m_{NaN{O_3}}} = {m_Z} + {m_Y} + {m_{{H_2}O}}\) \( \to 28,16 + 0,715.98 + 0,145.85 = 94,345 + 5,14 + {m_{{H_2}O}}\) \( \to \) \({m_{{H_2}O}} = 14,07g \to {n_{{H_2}O}} = 0,615\,\,mol\) Bảo toàn nguyên tố H : \(2{n_{{H_2}S{O_4}}} = 2{n_{{H_2}}} + 4{n_{NH_4^ + }} + 2{n_{{H_2}O}}\) \( \to 2.0,715 = 2{n_{{H_2}}} + 4.0,025 + 2.0,615 \to {n_{{H_2}}} = 0,05\,\,mol\) Đặt số mol của CO2, NO và N2 lần lượt là x, y, z \( \to x + y + z + 0,05 = 0,2 \to x + y + z = 0,15\) (*) Tổng khối lượng Y là 5,14 \( \to 44x + 30y + 28z + 0,05.2 = 5,14\) \( \to 44x + 30y + 28z = 5,04\) (**) Bảo toàn nguyên tố N : \({n_{NaN{O_3}}} = {n_{NO}} + 2{n_{{N_2}}} + {n_{NH_4^ + }} \to 0,145 = y + 2z + 0,025\) \( \to y + 2z = 0,12\) (***) Từ (*), (**) và (***) \( \to \) x = 0,04; y = 0,01; z = 0,04 \( \to {n_{FeC{O_3}}} = 0,04\,\,mol\) Gọi số mol của Mg và Fe3O4 lần lượt là a và b \( \to 24a + 232b + 116.0,04 = 28,16 \to 24a + 232b = 23,52\) (1) Vì tổng khối lượng của Mg và Fe trong hỗn hợp X là 21,92g \( \to 24a + 56.(3b + 0,04) = 21,92 \to 24a + 168b = 19,68\) (2) Từ (1) và (2) \( \to \) a = 0,4; b = 0,06 \( \to \% {m_{Mg}} = \dfrac{{0.4.24}}{{28,16}}.100\% = 34,09\% \) Câu 24 : Dung dịch X chứa 0,2 mol Fe(NO3)3 và 0,24 mol HCl. Dung dịch X có thể hòa tan được tối đa bao nhiêu gam Cu (biết phản ứng tạo khí NO là sản phẩm khử duy nhất)
Đáp án : C Phương pháp giải : Tính toán theo 2 PT ion rút gọn sau: PT ion rút gọn: 3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO↑ + 4H2O PT ion rút gọn: Cu + 2Fe3+ → Cu2+ + 2Fe2+ Lời giải chi tiết : PT ion rút gọn: 3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO↑ + 4H2O ban đầu: 0,24 0,6 (mol) pư: 0,09←0,24 →0,06 (mol) sau: 0,09 0,54 (mol) PT ion rút gọn: Cu + 2Fe3+ → Cu2+ + 2Fe2+ 0,1 ← 0,2 (mol) => ∑ nCu = 0,09 + 0,1 = 0,19 (mol) => mCu = 0,19.64 = 12,16 (g) Câu 25 : Cho hỗn hợp X chứa 18,6 gam gồm Fe, Al, Mg, FeO, Fe3O4 và CuO. Hòa tan hết trong dung dịch HNO3 dư thấy có 0,98 mol HNO3 tham gia phản ứng thu được 68,88 gam muối và 2,24 lít (đktc) khí NO duy nhất. Mặt khác, từ hỗn hợp X ta có thể điều chế được tối đa m gam kim loại. Giá trị của m là
Đáp án : A Phương pháp giải : X + HNO3 → Muối + NO + H2O BTKL: mH2O = mX + mHNO3 - m muối - mNO = ? => nH2O BTNT "H": nHNO3 = 4nNH4+ + 2nH2O => nNH4+ BTNT "N": nHNO3 = nNO3- + nNH4+ + nNO => nNO3- BTNT "O": nO(X) + 3nHNO3 = 3nNO3- + nNO + nH2O => nO(X) => m = mKL = mX - mO(X) Lời giải chi tiết : X + HNO3 → Muối + NO + H2O BTKL: mH2O = mX + mHNO3 - m muối - mNO = 18,6 + 0,98.63 - 68,88 - 0,1.30 = 8,46 gam => nH2O = 0,47 mol BTNT "H": nHNO3 = 4nNH4+ + 2nH2O => 0,98 = 4nNH4+ + 2.0,47 => nNH4+ = 0,01 mol BTNT "N": nHNO3 = nNO3- + nNH4+ + nNO => 0,98 = nNO3- + 0,01 + 0,1 => nNO3- = 0,87 mol BTNT "O": nO(X) + 3nHNO3 = 3nNO3- + nNO + nH2O => nO(X) + 3.0,98 = 3.0,87 + 0,1 + 0,47 => nO(X) = 0,24 mol => m = mKL = mX - mO(X) = 18,6 - 0,24.16 = 14,76 gam Câu 26 : Hỗn hợp X gồm Al và Fe có tỉ lệ số mol tương ứng là 1:1. Cho 2,49 gam X vào dung dịch chứa 0,17 mol HCl, thu được dung dịch Y. Cho 200 ml dung dịch AgNO3 1M vào Y, thu được khí NO và m gam chất rắn. Biết các phản ứng xảy ra hoàn toàn, NO là sản phẩm khử duy nhất của N+5. Giá trị của m gần nhất với giá trị nào sau đây
Đáp án : D Phương pháp giải : X + 0,17 mol HCl 2 Al + 6HCl → 2AlCl3 + 3H2 Fe + 2HCl → FeCl2 + H2 → Dung dịch Y thu được có AlCl3 : ? mol ; FeCl2 : ? mol; HCl : ? mol Y + 0,2 mol AgNO3 thì : 3Fe2+ + 4H+ + NO3- → 3Fe3+ + 2H2O + NO Ag+ + Cl- → AgCl =>\(n_{Fe^{2+}}, n_{Ag^+}\) còn lại Fe2+ + Ag+ → Fe3+ + Ag - Tính số mol Ag theo chất phản ứng hết trước Lời giải chi tiết : Đặt số mol Al và Fe trong X là x mol thì mX = 27x + 56x = 2,49 → x = 0,03 mol +) X + 0,17 mol HCl 2 Al + 6HCl → 2AlCl3 + 3H2 Fe + 2HCl → FeCl2 + H2 → Dd Y thu được có AlCl3: 0,03 mol; FeCl2: 0,03 mol; HCl: 0,02 mol +) Y + 0,2 mol AgNO3 thì : 3Fe2+ + 4H+ + NO3- → 3Fe3+ + 2H2O + NO 0,015 mol ← 0,02 mol Ag+ + Cl- → AgCl 0,17 0,17 0,17 (mol) \(n_{Fe^{2+}}còn\; lại =0,015\) mol \(n_{Ag^+}còn\; lại = 0,03\) mol Fe2+ + Ag+ → Fe3+ + Ag 0,015 0,03 => \(n_{Fe^{2+}}\) phản ứng hết trước => \(n_{Fe^{2+}}=n_{Ag}=0,015\) mol → mrắn = mAgCl + mAg = 0,17.143,5 + 0,015.108 = 24,395 + 1,62= 26,015 g → gần nhất với 26,0 g Câu 27 : HNO3 chỉ thể hiện tính oxi hóa khi tác dụng với các chất thuộc dãy nào dưới đây?
Đáp án : A Phương pháp giải : HNO3 thể hiện tính oxi hóa khi phản ứng với các chất khử (chất có khả năng tăng số oxi hóa) Lời giải chi tiết : A đúng B loại CuO, CaCO3 C loại CaO D loại Fe2O3 Câu 28 : Cho m gam hỗn hợp G gồm Mg và Al có tỉ lệ mol 4 : 5 vào dung dịch HNO3 20%. Sau khi các kim loại tan hết có 6,72 lít hỗn hợp X gồm NO, N2O, N2 bay ra (đktc) và được dung dịch T. Thêm một lượng O2 vừa đủ vào X, sau phản ứng được hỗn hợp khí Y. Dẫn Y từ từ qua dung dịch KOH dư, có 4,48 lít hỗn hợp khí Z đi ra (đktc). Tỉ khối của Z đối với H2 bằng 20. Nếu cho dung dịch NaOH vào dung dịch T thì lượng kết tủa lớn nhất thu được là (m + 39,1) gam. Biết HNO3 dùng dư 20% so với lượng cần thiết. Nồng độ phần trăm của Al(NO3)3 trong T gần nhất với
Đáp án : D Lời giải chi tiết : Khi thêm O2 vừa đủ vào Y thu được các khí NO2, N2O, N2. Dẫn qua dung dịch KOH dư thì NO2 bị hấp thụ khí còn lại là N2O và N2. => nNO = nNO2 = 0,3 – 0,2 = 0,1 mol Áp dụng đường chéo cho hỗn hợp Z:
Mà nN2O + nN2 = nZ = 0,2 mol => nN2O = 0,15 và nN2 = 0,05 Đặt: nMg = 4x và nAl = 5x (mol) => nMg(OH)2 = 4x và mAl(OH)3 = 5x m kết tủa max = mKL + mOH- => m + 39,1 = m + 17(4x.2 + 5x.3) => x = 0,1 => nMg = 0,4 mol và nAl = 0,5 mol Ta thấy: 2nMg + 3nAl > 3nNO + 8nN2O + 10nN2 => Có tạo muối NH4NO3 Bảo toàn e: 2nMg + 3nAl = 3nNO + 8nN2O + 10nN2 + 8nNH4NO3 => 2.0,4 + 3.0,5 = 3.0,1 + 8.0,15 + 10.0,05 + 8nNH4NO3 => nNH4NO3 = 0,0375 mol Công thức tính nhanh: nHNO3 pư = 4nNO + 10nN2O + 12nN2 + 10nNH4NO3 = 2,875 mol => nHNO3 bđ = 2,875 + 2,875.(20/100) = 3,45 mol => m dd HNO3 = 3,45.63.(100/20) = 1086,75 gam m dd sau pư = mMg + mAl + m dd HNO3 – mNO – mN2O – mN2 = 0,4.24 + 0,5.27 + 1086,75 – 0,1.30 – 0,15.44 – 0,05.28 = 1098,85 gam Ta có: nAl(NO3)3 = nAl = 0,5 mol → %mAl = (0,5.213/1098,85).100% = 9,69% gần nhất với 9,7% Câu 29 : HNO3 chỉ thể hiện tính axit khi tác dụng với các chất thuộc dãy nào dưới đây?
Đáp án : C Lời giải chi tiết : A loại vì HNO3 còn thể hiện tính oxi hóa khi tác dụng với Fe(OH)2 và FeO B loại vì HNO3 còn thể hiện tính oxi hóa khi tác dụng với FeCO3 C đúng D loại vì HNO3 còn thể hiện tính oxi hóa khi tác dụng với FeS Câu 30 : Cho m gam hỗn hợp X (gồm Mg, Al, Zn và Cu) tác dụng hết với dung dịch HNO3 thu được dung dịch Y (không có muối amoni) và 11,2 lít (đktc) hỗn hợp khí Z (gồm N2, NO, N2O và NO2, trong đó N2 và NO2 có phần trăm thể tích bằng nhau) có tỉ khối đối với heli bằng 8,9. Số mol HNO3 phản ứng là
Đáp án : C Phương pháp giải : HS ghi nhớ công thức tính nhanh số mol HNO3 đã phản ứng: nHNO3 = 12nN2 + 2nNO2 + 4nNO + 10nN2O = 12x + 2x + 4y + 10z = 14x + 4y +10z (*) Lời giải chi tiết :
nHNO3 = 12nN2 + 2nNO2 + 4nNO + 10nN2O = 12x + 2x + 4y + 10z = 14x + 4y +10z (*) *nZ = 2x + y + z = 0,5 mol (1) *mZ = nZ.MZ => 28x + 44x + 30y + 44z = 0,5.8,9.4 => 74x + 30y + 44z = 17,8 (2) \(\xrightarrow{{\dfrac{3}{7}(2) - \dfrac{{62}}{7}(1)}}14x + 4y + 10z = 3,2\)(**) (*) và (**) => nHNO3 = 3,2 mol Câu 31 : Cho 20 gam Fe tác dụng với HNO3 loãng thu được sản phẩm khử duy nhất NO. Sau khi phản ứng xảy ra hoàn toàn còn dư 3,2 gam Fe. Thể tích NO thu được ở đktc là :
Đáp án : C Phương pháp giải : Do Fe dư nên tạo thành muối Fe2+ Sử dụng định luật bảo toàn e: 2nFe = 3nNO => nNO = ? Lời giải chi tiết : Do Fe dư nên tạo thành muối Fe2+ nFe = (20 – 3,2)/56 = 0,3 mol BTe ta có: 2nFe = 3nNO => nNO = 2.0,3/3 = 0,2 mol => V = 4,48 lít Câu 32 : Cho hỗn hợp gồm 0,1 mol CuO và 0,1 mol Cu tác dụng với dung dịch HNO3 đặc nóng, dư thu được V lít khí NO2 (đktc). Giá trị của V là
Đáp án : C Phương pháp giải : Chỉ có Cu phản ứng với HNO3 sinh ra khí. Sử dụng định luật bảo toàn e ta có: 2nCu = nNO2 => nNO2 => V Lời giải chi tiết : Chỉ có Cu phản ứng với HNO3 sinh ra khí. Sử dụng định luật bảo toàn e ta có: 2nCu = nNO2 => nNO2 = 2.0,1 = 0,2 mol => V = 4,48 lít Câu 33 : Hòa tan hết 30 gam chất rắn gồm Mg, MgO, MgCO3 trong dung dịch HNO3 thấy có 2,15 mol HNO3 phản ứng. Sau phản ứng thu được 4,48 lít (đktc) hỗn hợp khí NO, CO2 có tỉ khối so với H2 là 18,5 và dung dịch X chứa m gam muối. Giá trị m là
Đáp án : B Phương pháp giải : Bước 1: Tính nNO và nCO2 - Đặt số mol của NO và CO2 lần lượt là a và b (mol). - Lập hệ phương trình tính a, b: từ thể tích và tỉ khối của hỗn hợp khí tính được số mol mỗi khí. Bước 2: Tính nMg, nMgO, nNH4NO3 tạo thành - Đặt ẩn là số mol của Mg, MgO, NH4NO3. Lập hệ 3 phương trình dựa vào: - Hỗn hợp ban đầu chứa: Mg (x); MgO (y); MgCO3 (0,1). Đặt nNH4NO3 = z mol. - Lập hệ phương trình tính x, y, z: + Khối lượng hỗn hợp ban đầu: mhh = 24x + 40y + 0,1.84 + Bảo toàn e: 2nMg = 3nNO + 8nNH4NO3. + Muối tạo thành gồm Mg(NO3)2 và NH4NO3 Bảo toàn nguyên tố N: nHNO3 = 2nMg(NO3)2 + 2nNH4NO3 + nNO. Bước 3: Tính mmuối trong X. - Từ số mol các muối tính được khối lượng muối trong X. Lời giải chi tiết : Bước 1: Tính nNO và nCO2 - Đặt số mol của NO và CO2 lần lượt là a và b (mol). +) nkhí = 0,2 mol ⟹ a + b = 0,2 +) mkhí = 0,2.18,5.2 = 7,4 gam ⟹ 30a + 44b = 7,4 Giải hệ trên được a = b = 0,1. Bước 2: Tính nMg, nMgO, nNH4NO3 tạo thành - Hỗn hợp ban đầu chứa: Mg (x); MgO (y); MgCO3 (0,1). Đặt nNH4NO3 = z mol. +) mhh = 30 gam ⟹ 24x + 40y + 0,1.84 = 30 (1) +) BTe: 2nMg = 3nNO + 8nNH4NO3 ⟹ 2x = 3.0,1 + 8z (2) +) Muối chứa Mg(NO3)2 (x + y + 0,1) và NH4NO3 (z) Bảo toàn nguyên tố N: nHNO3 = 2nMg(NO3)2 + 2nNH4NO3 + nNO ⟹ 2,15 = 2(x + y + 0,1) + 2z + 0,1 (3) Từ (1)(2)(3) ⟹ x = 0,65; y = 0,15; z = 0,125. Bước 3: Tính mmuối trong X. mmuối = mMg(NO3)2 + mNH4NO3 = 143,2 gam. Câu 34 : Hỗn hợp X gồm a mol P và b mol S. Hoà tan hoàn toàn X trong dung dịch HNO3 đặc, nóng lấy dư 20% so với lượng cần phản ứng thu được dung dịch Y và thoát ra khí NO2 (sản phẩm khử duy nhất). Trung hoà dung dịch Y bằng NaOH thì cần bao nhiêu mol?
Đáp án : D Phương pháp giải : - Cách 1: Tính toán theo các PTHH Bước 1: Viết các PTHH của P tác dụng với HNO3 đặc và S tác dụng với HNO3 đặc. P + 5HNO3 đ \(\xrightarrow{{{t^o}}}\) H3PO4 + 5NO2 + H2O S + 6HNO3 đ \(\xrightarrow{{{t^o}}}\) H2SO4 + 6NO2 + 2H2O Bước 2: Tính nHNO3 pứ và nHNO3 dư - Đặt số mol của P, S là a, b - Từ PTHH, tính nHNO3 pứ và nHNO3 dư Bước 3: Xác định thành phần dd Y và viết các PTHH khi trung hòa Bước 4: Tính nNaOH - Cách 2: Sử dụng bảo toàn e Bước 1: Tính nHNO3 pư và nHNO3 dư Áp dụng bảo toàn e: nNO2 = 5nP + 6nS. Bảo toàn nguyên tố N: nHNO3 pư = nNO2 ⟹ nHNO3 dư = 20%.nHNO3 pư. Bước 2: Tính nNaOH Khi trung hòa thì nOH- = nH+ ⟹ nNaOH = 3nH3PO4 + 2nH2SO4 + nHNO3 dư. Lời giải chi tiết : Cách 1: Viết PTHH Bước 1: Viết các PTHH của P tác dụng với HNO3 đặc và S tác dụng với HNO3 đặc. P + 5HNO3 đ \(\xrightarrow{{{t^o}}}\) H3PO4 + 5NO2 + H2O a → 5a → a (mol) S + 6HNO3 đ \(\xrightarrow{{{t^o}}}\) H2SO4 + 6NO2 + 2H2O b → 6b → b (mol) Bước 2: Tính nHNO3 pứ và nHNO3 dư - Đặt số mol của P, S là a, b ⟹ nHNO3 pứ = 5a + 6b (mol) ⟹ nHNO3 dư = 20%.nHNO3 pứ = 20%.(5a + 6b) = a + 1,2b (mol) Bước 3: Xác định thành phần dd Y và viết các PTHH khi trung hòa - Dung dịch Y gồm \(\left\{ \begin{array}{l}{H_3}P{O_4}:\,\,a\left( {mol} \right)\\{H_2}S{O_4}:b\left( {mol} \right)\\HN{O_3}:a + 1,2b\left( {mol} \right)\end{array} \right.\) - Các phản ứng xảy ra khi trung hòa: H3PO4 + 3NaOH → Na3PO4 + 3H2O H2SO4 + 2NaOH → Na2SO4 + 2H2O HNO3 + NaOH → NaNO3 + H2O Bước 4: Tính nNaOH - nNaOH = 3nH3PO4 + 2nH2SO4 + nHNO3 dư = 3a + 2b + (a + 1,2b) = 4a + 3,2b (mol) Cách 2: Sử dụng bảo toàn e Bước 1: Tính nHNO3 pư và nHNO3 dư - Đặt số mol của P, S là a, b - Khi X + HNO3: \(\left\{ \begin{array}{l}P\left( a \right)\\S\left( b \right)\end{array} \right. + HN{O_3} \to \left\{ \begin{array}{l}{H_3}P{O_4}\left( a \right)\\{H_2}S{O_4}\left( b \right)\\HN{O_3}du\end{array} \right. + N{O_2} + {H_2}O\) - Áp dụng bảo toàn e: 5nP + 6nS = nNO2 = 5a + 6b (mol) - Bảo toàn nguyên tố N: nHNO3 pư = nNO2 = 5a + 6b (mol) ⟹ nHNO3 dư = 20%.(5a + 6b) = a + 1,2b (mol) Bước 2: Tính nNaOH - Khi trung hòa thì nOH- = nH+ ⟹ nNaOH = 3nH3PO4 + 2nH2SO4 + nHNO3 dư = 3.a + 2.b + (a + 1,2b) = 4a + 3,2b (mol).
|