Trắc nghiệm Ôn tập chương 3 - Hóa 11Đề bài Câu 1 : Phản ứng nào sau đây không đúng
Câu 2 : Trong công nghiệp CO được điều chế bằng phương pháp nào?
Câu 3 : Ứng dụng nào sau đây không sử dụng tính bán dẫn của Si?
Câu 4 : Khi nhiệt phân hỗn hợp chất rắn sau: (NH4)2CO3, KHCO3, Mg(HCO3)2, FeCO3 đến khối lượng không đổi trong môi trường không có không khí thì sản phẩm rắn gồm các chất:
Câu 5 : Dãy chất nào sau đây có thể tác dụng với cacbon ?
Câu 6 : Trong các phản ứng hoá học sau đây phản ứng nào mà C, Si thể hiện tính oxi hoá? 1- C + H2 2-C + H2O 3-C + Ca 4-Si + Mg 5- Si + dd NaOH 6-C + O2 7-Si + Cl2
Câu 7 : Cho khí CO dư đi qua hỗn hợp rắn: MgO, CuO, Al2O3, Fe3O4 khi đun nóng thì chất rắn còn lại trong bình là
Câu 8 : Trong các cặp chất sau đây: a) C + H2O b)(NH4)2CO3 + KOH c) NaOH + CO2 d) CO2 + Ca(OH)2 e) K2CO3 + BaCl2 g) Na2CO3 + Ca(OH)2 h) CaCO3 + HCl i) HNO3 + NaHCO3 k) CO + CuO. Nhóm gồm các cặp chất mà phản ứng giữa các chất sinh ra sản phẩm khí là:
Câu 9 : Cho các nhận xét sau, nhận xét nào không đúng ?
Câu 10 : Cho các câu nhận xét sau, câu nhận xét không đúng là:
Câu 11 : Sục V lít khí CO2 (đktc) vào 100 ml dung dịch Ba(OH)2 2,5M thu được 23,64 gam kết tủa. Giá trị lớn nhất của V là:
Câu 12 : Sục hoàn toàn 6,72 lít khí CO2 (đktc) vào 100 ml hỗn hợp dung dịch NaOH 2M và Ca(OH)2 1,5M thu được a gam kết tủa. Giá trị của a là:
Câu 13 : Cho luồng khí CO dư đi qua ống sứ đựng 20 gam hỗn hợp A gồm MgO và CuO nung nóng. Sau khi phản ứng hoàn toàn đem cân lại thấy khối lượng chất rắn giảm đi 3,2 gam. Tính % CuO trong hỗn hợp
Câu 14 : Dẫn khí CO dư qua ống đựng bột một oxit sắt (FexOy) ở nhiệt độ cao. Sau khi phản ứng kết thúc thu được 0,84 gam sắt và dẫn khí sinh ra vào nước vôi trong dư thì thu được 2 gam kết tủa. Xác định công thức phân tử của FexOy.
Câu 15 : Dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M và KHCO3 1M. Nhỏ từ từ từng giọt cho đến hết 200 ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí (ở đktc). Giá trị của V là
Câu 16 : Nhỏ từ từ từng giọt đến hết 30ml dung dịch HCl 1M vào 100ml dung dịch chứa Na2CO3 0,2M và NaHCO3 0,2M, sau phản ứng thu được số mol CO2 là:
Câu 17 : Hấp thụ hoàn toàn 0,16 mol CO2 vào 2 lít dd Ca(OH)2 0,05 M thu được kết tủa X và dd Y. Cho biết khổi lượng dd Y tăng hay giảm bao nhiêu so với dd Ca(OH)2 ban đầu?
Câu 18 : Cho 24,4 gam hỗn hợp Na2CO3, K2CO3 tác dụng vừa đủ với dung dịch BaCl2. Sau phản ứng thu được 39,4 gam kết tủa. Lọc tách kết tủa, cô cạn dung dịch thu được m gam muối clorua. Tính m.
Câu 19 : Đem nhiệt phân hoàn toàn 15 gam muối cacbonat của một kim loại hóa trị II. Dẫn hết khí sinh ra vào 200 gam dung dịch NaOH 4% (vừa đủ) thì thu được dung dịch mới có nồng độ các chất tan là 6,63%. Xác định công thức muối đem nhiệt phân.
Câu 20 : Đổ từ từ 200 ml dung dịch A (Na2CO3 1M và K2CO3) vào 200 ml dung dịch (Na+ 1M, Ba2+ 1M, Ca2+ 1M, Cl- 2,5 M và HCO3-) thu được m gam kết tủa và dung dịch B. Đổ thêm 100 ml dung dịch A vào B, sau phản ứng thấy nồng độ CO32- trong dung dịch bằng 1/4 nồng độ của HCO3-. Hãy tìm nồng độ của K2CO3 trong A:
Câu 21 : Cho các phát biểu sau: (1) Nguyên nhân ngộ độc khi sưởi ấm bằng than trong phòng kín chủ yếu do khí CO2. (2) Trong các mặt nạ chống độc người ta thường cho bột than hoạt tính. (3) Ure là loại phân đạm tốt nhất có công thức là (NH2)2CO. (4) Thuốc nổ đen (người Trung Quốc tìm ra) là hỗn hợp: KNO3 + S + C. (5) Tinh thể Al2O3 có lẫn tạp chất Fe2+, Fe3+ và Ti4+ ta có đá saphia dùng làm đồ trang sức. Số phát biểu đúng là
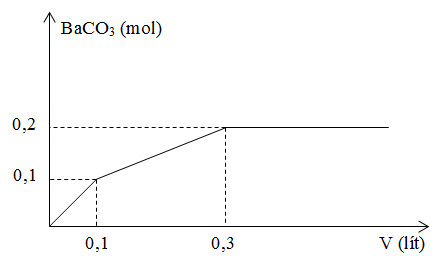
Câu 22 : Nhỏ từ từ V lít dung dịch chứa Ba(OH)2 0,5M vào dung dịch chứa x mol NaHCO3 và y mol BaCl2. Đồ thị sau đây biểu diễn sự phụ thuộc giữa số mol kết tủa và thể tích dung dịch Ba(OH)2.
Giá trị x, y tương ứng là
Câu 23 : Chọn phát biểu đúng.
Câu 24 : Hấp thụ hết 0,1 mol CO2 vào dung dịch có chứa 0,08 mol NaOH và 0,1 mol Na2CO3, thu được dung dịch X. Nhỏ từ từ dung dịch HCl vào dung dịch X đến khi thoát ra 0,08 mol khí CO2 thì thấy hết x mol HCl. Giá trị của x là
Câu 25 : Tiến hành các thí nghiệm sau ở điều kiện thường: (a) Sục khí SO2 vào dung dịch H2S. (b) Sục khí F2 vào nước. (c) Cho KMnO4 vào dung dịch HCl đặc. (d) Sục khí CO2 vào dung dịch NaOH. (e) Cho Si vào dung dịch NaOH. (g) Cho Na2SO3 vào dung dịch H2SO4. (h) C + H2O(hơi) ở nhiệt độ cao. (i) Nung Cu(NO3)2. (k) Dẫn CO qua FeO nung nóng. Số thí nghiệm có sinh ra đơn chất là
Lời giải và đáp án Câu 1 : Phản ứng nào sau đây không đúng
Đáp án : B Lời giải chi tiết : B sai vì axit H2SiO3 yếu hơn axit H2CO3 nên phản ứng không xảy ra Câu 2 : Trong công nghiệp CO được điều chế bằng phương pháp nào?
Đáp án : C Lời giải chi tiết : Trong công nghiệp CO được điều chế bằng phương pháp : cho hơi nước đi qua than nóng đỏ ở 10500C C + H2O $\xrightarrow{{{t^o}}}$ CO + H2 Câu 3 : Ứng dụng nào sau đây không sử dụng tính bán dẫn của Si?
Đáp án : D Lời giải chi tiết : Ứng dụng không sử dụng tính bán dẫn của Si là tạo ferosilic. Vì ferosilic là hợp kim của sắt được sử dụng trong ngành luyện thép. Câu 4 : Khi nhiệt phân hỗn hợp chất rắn sau: (NH4)2CO3, KHCO3, Mg(HCO3)2, FeCO3 đến khối lượng không đổi trong môi trường không có không khí thì sản phẩm rắn gồm các chất:
Đáp án : A Phương pháp giải : Nắm được phản ứng nhiệt phân muối cacbonat: - Muối cacbonat trung hòa của kim loại kiềm đều không bị nhiệt phân - Các muối cacbonat trung hòa của KL khác bị nhiệt phân thành oxit tương ứng và CO2 (trong muôi trường không có không khí) - Muối hidrocacbonat bị nhiệt phân (đến khối lượng không đổi): + Nếu là muối của KL kiềm: tạo muối cacbonat trung hòa, CO2, H2O + Nếu là muối của các KL khác: tạo oxit tương ứng, CO2, H2O - Muối amoni cacbonat nhiệt phân tạo NH3, CO2 , H2O Lời giải chi tiết : Nhiệt phân đến khối lượng không đổi: (NH4)2CO3 → 2NH3 + CO2 + H2O 2KHCO3 → K2CO3 + H2O + CO2 Mg(HCO3)2 → MgO + CO2 + H2O FeCO3 → FeO + CO2 Như vậy chất rắn sau phản ứng gồm: FeO, MgO, K2CO3 Câu 5 : Dãy chất nào sau đây có thể tác dụng với cacbon ?
Đáp án : D Phương pháp giải : +) C là vừa có tính khử vừa có tính oxi hóa => C có thể tác dụng với kim loại, phi kim, oxit kim loại... Lời giải chi tiết : C không tác dụng với HCl loại A C không tác dụng với NaOH loại B C không tác dụng với NaCl loại C Câu 6 : Trong các phản ứng hoá học sau đây phản ứng nào mà C, Si thể hiện tính oxi hoá? 1- C + H2 2-C + H2O 3-C + Ca 4-Si + Mg 5- Si + dd NaOH 6-C + O2 7-Si + Cl2
Đáp án : B Phương pháp giải : +) Chất oxi hóa là chất nhận e => số oxi hóa giảm Lời giải chi tiết : 1. Tạo thành CH4 => số oxi hóa giảm xuống -4 => tính oxi hóa 2. Tạo thành CO hoặc CO2 => số oxi tăng lên +2 hoặc +4 => tính khử 3. Tạo thành CaC2 => số oxi hóa giảm xuống -1 => tính oxi hóa 4. Tạo thành Mg2Si => số oxi hóa giảm xuống -4 => tính oxi hóa 5. Tạo thành Na2SiO3 => số oxi hóa tăng lên +4 => tính khử 6. Tạo thành CO hoặc CO2 => số oxi tăng lên +2 hoặc +4 => tính khử 7. Tạo thành SiCl4 => số oxi hóa tăng lên +4 => tính khử Câu 7 : Cho khí CO dư đi qua hỗn hợp rắn: MgO, CuO, Al2O3, Fe3O4 khi đun nóng thì chất rắn còn lại trong bình là
Đáp án : C Phương pháp giải : Các oxit của kim loại đứng sau nhôm mới bị khử bởi CO, H2, C, Al Lời giải chi tiết : Những oxit bị khử tạo KL là: CuO và Fe3O4 Chất rắn sau phản ứng gồm: MgO, Cu, Al2O3, Fe Câu 8 : Trong các cặp chất sau đây: a) C + H2O b)(NH4)2CO3 + KOH c) NaOH + CO2 d) CO2 + Ca(OH)2 e) K2CO3 + BaCl2 g) Na2CO3 + Ca(OH)2 h) CaCO3 + HCl i) HNO3 + NaHCO3 k) CO + CuO. Nhóm gồm các cặp chất mà phản ứng giữa các chất sinh ra sản phẩm khí là:
Đáp án : D Phương pháp giải : Dựa vào phản ứng hóa học giữa các chất để trả lời Lời giải chi tiết : Ta có PTHH của phản ứng: a) C + H2O $\xrightarrow{{{t^o}}}$ CO↑ + H2↑ C + 2H2O $\xrightarrow{{{t^o}}}$ CO2↑ + 2H2↑ b) (NH4)2CO3 + 2KOH → 2NH3↑+ K2CO3 + 2H2O c) NaOH + CO2 → NaHCO3 2NaOH + CO2 → Na2CO3 + H2O d) 2CO2 + Ca(OH)2 → Ca(HCO3)2 CO2 + Ca(OH)2 → CaCO3↓ + H2O e) K2CO3 + BaCl2 → BaCO3↓ + 2KCl g) Na2CO3 + Ca(OH)2 → CaCO3↓ + 2NaOH h) CaCO3 + HCl → CaCl2 + H2O + CO2↑ i) HNO3 + NaHCO3 → NaNO3 + H2O + CO2↑ k) CO + CuO $\xrightarrow{{{t^o}}}$ Cu + CO2↑ Vậy các phản ứng tạo khí là: a, b, h, i, k Câu 9 : Cho các nhận xét sau, nhận xét nào không đúng ?
Đáp án : C Lời giải chi tiết : Nhận xét không đúng là: Trong tự nhiên C cũng như Si đều chỉ tồn tại dạng hợp chất. Câu 10 : Cho các câu nhận xét sau, câu nhận xét không đúng là:
Đáp án : D Lời giải chi tiết : Câu không đúng là: CO2 là chất khí dùng để chữa cháy, nhất là các đám cháy kim loại. Không dùng CO2 để dập tắt các đám cháy kim loại Mg, Al vì $\mathop C\limits^{ + 4} {O_2}$+ 2Mg $\xrightarrow{{{t^0}}}\mathop C\limits^0 $ + 2MgO Câu 11 : Sục V lít khí CO2 (đktc) vào 100 ml dung dịch Ba(OH)2 2,5M thu được 23,64 gam kết tủa. Giá trị lớn nhất của V là:
Đáp án : B Phương pháp giải : Viết dạng phương trình song song và đặt mol: CO2 + Ba(OH)2 → BaCO3 +H2O 2CO2 + Ba(OH)2 → Ba(HCO3)2
Lời giải chi tiết : nBa(OH)2 = 0,25mol n kết tủa = 0,12mol CO2 + Ba(OH)2 → BaCO3 +H2O 0,12$ \leftarrow $ 0,12$ \leftarrow $ 0,12 2CO2 + Ba(OH)2 → Ba(HCO3)2 0,26 $ \leftarrow $0,13 $ \leftarrow $0,13 nCO2 = 0,26 + 0,12 = 0,38 mol => V = 8,512 lít Câu 12 : Sục hoàn toàn 6,72 lít khí CO2 (đktc) vào 100 ml hỗn hợp dung dịch NaOH 2M và Ca(OH)2 1,5M thu được a gam kết tủa. Giá trị của a là:
Đáp án : D Phương pháp giải : Tính tỉ lệ: (*) = nOH-/nCO2 + (*) ≤ 1 => chỉ tạo muối HCO3- + 1 < (*) < 2 => tạo 2 muối HCO3- và CO32- + (*) ≥ 2 => chỉ tạo muối CO32- Viết Phương trình ion, tính toán CO2 + 2OH- → CO32- +H2O CO2 + CO32- +H2O - → 2HCO3- Ca2+ + CO32- → CaCO3 Lời giải chi tiết : \(\begin{array}{*{20}{l}} $\frac{{{n_{O{H^ - }}}}}{{{n_{C{O_2}}}}} = \frac{{0,5}}{{0,3}} = 1,67$ Vì 1 < 1,67 <2 nên phản ứng tạo CO32- và HCO3- CO2 + 2OH- → CO32- +H2O 0,25 \( \leftarrow \)0,5 → 0,25 CO2 + CO32- +H2O - → HCO3- 0,05 → 0,05 \({n_{C{O_3}^{2 - }}} = \) 0,25 – 0,05 =0,2 mol \({n_{C{a^{2 + }}}} = {\rm{ }}0,15mol\) Ca2+ + CO32- → CaCO3 0,15 → 0,15 a = 0,15 . 100 = 15g Câu 13 : Cho luồng khí CO dư đi qua ống sứ đựng 20 gam hỗn hợp A gồm MgO và CuO nung nóng. Sau khi phản ứng hoàn toàn đem cân lại thấy khối lượng chất rắn giảm đi 3,2 gam. Tính % CuO trong hỗn hợp
Đáp án : D Phương pháp giải : +) CO không khử được MgO +) Vậy khối lượng chất rắn giảm là mO (trong CuO) Từ đó tính được nO (trong CuO) = nCuO Lời giải chi tiết : CO không khử được MgO m chất rắn giảm = mO (trong CuO) = 3,2 gam => nO (trong CuO) = nCuO = 3,2 : 16 = 0,2 mol => mCuO = 0,2 . 80 = 16g => % CuO =$\frac{{16}}{{20}}*100\% = $ 80% Câu 14 : Dẫn khí CO dư qua ống đựng bột một oxit sắt (FexOy) ở nhiệt độ cao. Sau khi phản ứng kết thúc thu được 0,84 gam sắt và dẫn khí sinh ra vào nước vôi trong dư thì thu được 2 gam kết tủa. Xác định công thức phân tử của FexOy.
Đáp án : C Phương pháp giải : +) BTNT Cacbon => ${n_{C{O_2}}} = {n_{CaC{{\text{O}}_3}}}$ +) Viết PTHH tính toán +) ${n_{F{\text{e}}}} = \dfrac{x}{y}.{n_{C{O_2}}} \Rightarrow \dfrac{x}{y}$ Lời giải chi tiết : ${n_{CaC{O_3}}} = \dfrac{2}{{100}} = 0,02{\text{ }}mol;{\text{ }}{n_{Fe}} = \dfrac{{0,84}}{{56}} = 0,015{\text{ }}mol$ Phản ứng : FexOy + yCO $\xrightarrow{{{t^o}}}$ xFe + yCO2 (1) 0,02x/y ← 0,02 ${n_{CaC{{\text{O}}_3}}} = 0,02\,mol \Rightarrow \,{n_{C{O_2}}} = 0,02\,mol$ Theo phản ứng (1): ${n_{F{\text{e}}}} = \dfrac{x}{y}.{n_{C{O_2}}} = \dfrac{{0,02{\text{x}}}}{y} = 0,015 \Rightarrow \dfrac{x}{y} = \dfrac{{0,015}}{{0,02}} = \dfrac{3}{4}$ Vậy CTPT của oxit là Fe3O4 Câu 15 : Dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M và KHCO3 1M. Nhỏ từ từ từng giọt cho đến hết 200 ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí (ở đktc). Giá trị của V là
Đáp án : D Phương pháp giải : Với bài toán nhỏ từ từ axit vào muối cacbonat và ngược lại . Ta có : +) Nhỏ từ từ axit vào muối cacbonat thì ban đầu H+ thiếu nên thứ tự phản ứng là: CO32- + H+ → HCO3- HCO3- + H+ → CO2 + H2O +) Nhỏ từ từ muối cacbonat vào axit thì ban đầu H+ rất dư nên phản ứng là: 2H+ + CO32- → CO2 + H2O HCO3- + H+ → CO2 + H2O Lời giải chi tiết : Phản ứng xảy ra theo thứ tự sau: CO32- + H+ → HCO3- (1) 0,15mol→0,15mol→0,15mol HCO3- + H+ → CO2 + H2O(2) 0,05mol ←0,05mol → 0,05mol Sau phản ứng (2) HCO3- còn dư 0,2 mol V = 1,12 lít Câu 16 : Nhỏ từ từ từng giọt đến hết 30ml dung dịch HCl 1M vào 100ml dung dịch chứa Na2CO3 0,2M và NaHCO3 0,2M, sau phản ứng thu được số mol CO2 là:
Đáp án : D Phương pháp giải : Với bài toán nhỏ từ từ axit vào muối cacbonat và ngược lại . Ta có : +) Nhỏ từ từ axit vào muối cacbonat thì ban đầu H+ thiếu nên thứ tự phản ứng là: CO32- + H+ → HCO3- HCO3- + H+ → CO2 + H2O +) Nhỏ từ từ muối cacbonat vào axit thì ban đầu H+ rất dư nên phản ứng là: 2H+ + CO32- →CO2 + H2O HCO3- + H+ → CO2 + H2O Lời giải chi tiết : Phản ứng xảy ra theo thứ tự sau: CO32- + H+ → HCO3- (1) 0,02mol ← 0,02mol →0,02mol HCO3- + H+ → CO2 + H2O(2) 0,01mol ← 0,01mol → 0,01mol Sau phản ứng (2) HCO3- còn dư 0,01 mol Vậy số mol CO2 là 0,01 mol. Câu 17 : Hấp thụ hoàn toàn 0,16 mol CO2 vào 2 lít dd Ca(OH)2 0,05 M thu được kết tủa X và dd Y. Cho biết khổi lượng dd Y tăng hay giảm bao nhiêu so với dd Ca(OH)2 ban đầu?
Đáp án : C Phương pháp giải : +) Viết PTHH tính toán tìm khối lượng kết tủa (${m_{CaC{O_3}}}$) +) Khối lượng dung dịch tăng giảm là $m = {m_{C{O_2}}} - m$ kết tủa Lời giải chi tiết : Ta có PTHH: CO2 + Ca(OH)2 → CaCO3 + H2O 0,1 ← 0,1 ← 0,1 2CO2 + CaCO3 + H2O → Ca(HCO3)2 0,16 – 0,1 → 0,06 => n↓= 0,04 mol n↓= 0,04 mol => m ↓ = 4g < 0,16.44 = 7,04g => mdd tăng = 7,04 – 4 = 3,04g Câu 18 : Cho 24,4 gam hỗn hợp Na2CO3, K2CO3 tác dụng vừa đủ với dung dịch BaCl2. Sau phản ứng thu được 39,4 gam kết tủa. Lọc tách kết tủa, cô cạn dung dịch thu được m gam muối clorua. Tính m.
Đáp án : A Phương pháp giải : +) ${n_{BaC{l_2}}} = {n_{BaC{O_3}}}$ +) bảo toàn khối lượng: ${m_{hh}} + {m_{BaC{l_2}}} = {m_ \downarrow } + m$ Lời giải chi tiết : ${n_{BaC{l_2}}} = {n_{BaC{O_3}}} = 0,2{\text{ }}mol$ Áp dụng định luật bảo toàn khối lượng: ${m_{hh}} + {m_{BaC{l_2}}} = {m_ \downarrow } + m$ muối Clorua => m = 24,4 + 0,2.208 - 39,4 = 26,6 gam Câu 19 : Đem nhiệt phân hoàn toàn 15 gam muối cacbonat của một kim loại hóa trị II. Dẫn hết khí sinh ra vào 200 gam dung dịch NaOH 4% (vừa đủ) thì thu được dung dịch mới có nồng độ các chất tan là 6,63%. Xác định công thức muối đem nhiệt phân.
Đáp án : D Phương pháp giải : TH1: Chất tan là 2 muối nên ta đặt Na2CO3 có số mol là x => tính số mol NaHCO3 +) mdd sau phản ứng = mCO2 + mdd NaOH +) m chất tan = mNa2CO3 + mNaHCO3 = 106.x + 84.(0,2 - 2x) Thay vào biểu thức tính c% => x +) Bảo toàn nguyên tố C: ${n_{RC{O_3}}} = {n_{C{O_2}}}$ => ${M_{MC{O_3}}}$ TH2: Chất tan là NaOH và Na2CO3 sau đó làm tương tự như TH1 Lời giải chi tiết : Gọi công thức phân tử của muối cacbonat là RCO3 nNaOH = 0,2 mol TH1 chất tan là 2 muối nên ta đặt Na2CO3 có số mol là x 2NaOH + CO2 → Na2CO3 + H2O 2x ← x ← x NaOH + CO2 → NaHCO3 (0,2-2x)→(0,2-2x)→(0,2-2x) nCO2 = 0,2 - x => mCO2 = (0,2 - x).44 Sau phản ứng : mdd = 200 + (0,2 - x).44 m chất tan = mNa2CO3 + mNaHCO3 = 106.x + 84.(0,2 - 2x) Theo gt: nồng độ các chất tan là 6,63% => $\dfrac{{106.x + 84.\left( {0,2 - 2x} \right)}}{{200 + 44.(0,2 - x)}} = \dfrac{{6,63}}{{100}} \Rightarrow x = 0,05$ => x = 0,05 $ \Rightarrow {n_{C{O_2}}} = {n_{N{a_2}C{O_3}}} + {n_{NaHC{O_3}}} = 0,05 + 0,2 - 2.0,05 = 0,15\,mol$ Bảo toàn nguyên tố C: ${n_{RC{O_3}}} = {n_{C{O_2}}} = 0,15\,mol$ => MRCO3 = 15 / 0,15 = 100 => R = 40 Công thức muối cacbonat là CaCO3 TH2: NaOH dư Số mol NaOH dư = 2x 2NaOH + CO2 → Na2CO3 + H2O 0,2-2x ← 0,1-x ←0,1-x Sau phản ứng : mdd = 200 + (0,1 - x).44 m chất tan = mNa2CO3 + mNaOH = 106.(0,1-x )+ 40*2.x Theo gt: nồng độ các chất tan là 6,63% => $\dfrac{{106.(0,1-x) + 80.\left( {x} \right)}}{{200 + 44.(0,1 - x)}} = \dfrac{{6,63}}{{100}} \Rightarrow x = 0,128$ => x = 0,128 >0,1 (loại) Câu 20 : Đổ từ từ 200 ml dung dịch A (Na2CO3 1M và K2CO3) vào 200 ml dung dịch (Na+ 1M, Ba2+ 1M, Ca2+ 1M, Cl- 2,5 M và HCO3-) thu được m gam kết tủa và dung dịch B. Đổ thêm 100 ml dung dịch A vào B, sau phản ứng thấy nồng độ CO32- trong dung dịch bằng 1/4 nồng độ của HCO3-. Hãy tìm nồng độ của K2CO3 trong A:
Đáp án : A Phương pháp giải : Bảo toàn điện tích Lời giải chi tiết : Bảo toàn điện tích: \({C_{HCO_3^ - }}\) trong 200 ml dung dịch là 2,5M. ⇒\({n_{HCO_3^ - }}\) =2,5 . 0,2 = 0,5 mol Xét tổng thể: đổ 300 ml dung dịch A và 200 ml dung dịch. Sau khi trộn: ⇒\({n_{HCO_3^ - }}\)=\({n_{CO_3^ 2- }}\) /4 =0,125 mol Gọi nồng độ K2CO3 trong A là x ⇒ \({n_{HCO_3^ - }}\) tổng= 0,3.(1 + x) Sau trộn sẽ phản ứng với Ca2+, Ba2+ \({n_{HCO_3^ 2- }}\) còn lại = 0,3 . (1 + x) - 0,2 - 0,2 = 0,125 ⇒ x = 0,75M Câu 21 : Cho các phát biểu sau: (1) Nguyên nhân ngộ độc khi sưởi ấm bằng than trong phòng kín chủ yếu do khí CO2. (2) Trong các mặt nạ chống độc người ta thường cho bột than hoạt tính. (3) Ure là loại phân đạm tốt nhất có công thức là (NH2)2CO. (4) Thuốc nổ đen (người Trung Quốc tìm ra) là hỗn hợp: KNO3 + S + C. (5) Tinh thể Al2O3 có lẫn tạp chất Fe2+, Fe3+ và Ti4+ ta có đá saphia dùng làm đồ trang sức. Số phát biểu đúng là
Đáp án : D Phương pháp giải : Dựa vào kiến thức tổng hợp các chất vô cơ Lời giải chi tiết : (1) sai do khí CO chứ không phải CO2 (2) đúng, vì than hoạt tính có tính hấp phụ (3) đúng, vì ure có hàm lượng nito cao nhất nhé (4) đúng (5) đúng → có 4 phát biểu đúng Câu 22 : Nhỏ từ từ V lít dung dịch chứa Ba(OH)2 0,5M vào dung dịch chứa x mol NaHCO3 và y mol BaCl2. Đồ thị sau đây biểu diễn sự phụ thuộc giữa số mol kết tủa và thể tích dung dịch Ba(OH)2.
Giá trị x, y tương ứng là
Đáp án : A Phương pháp giải : - Tại V = 0,3 thì lượng BaCO3 đạt cực đại và không đổi. Khi đó: + nBaCO3 max = nCO32- max = nNaHCO3 = x + BTNT "Ba": nBaCO3 = nBa(OH)2 + nBaCl2 => y Lời giải chi tiết : - Tại V = 0,3 thì lượng BaCO3 đạt cực đại và không đổi. Khi đó: + nBaCO3 max = nCO32- max = nNaHCO3 = x = 0,2 mol + BTNT "Ba": nBaCO3 = nBa(OH)2 + nBaCl2 hay 0,2 = 0,3.0,5 + y => y = 0,05 mol Câu 23 : Chọn phát biểu đúng.
Đáp án : B Lời giải chi tiết : Cacbon và silic thuộc cùng một nhóm A, mà điện tích hạt nhân của Silic lớn hơn Cacbon nên Silic có tính khử lớn hơn Cacbon hay Silic có tính oxi hóa yếu hơn Cacbon Câu 24 : Hấp thụ hết 0,1 mol CO2 vào dung dịch có chứa 0,08 mol NaOH và 0,1 mol Na2CO3, thu được dung dịch X. Nhỏ từ từ dung dịch HCl vào dung dịch X đến khi thoát ra 0,08 mol khí CO2 thì thấy hết x mol HCl. Giá trị của x là
Đáp án : A Phương pháp giải : Giả sử hấp thụ CO2 vào dung dịch NaOH và Na2CO3 thu được CO32- (a mol) và HCO3- (b mol) BTNT “C”: nCO2 + nNa2CO3 = nCO3 2- + nHCO3- => (1) BTĐT: nNa+ = 2nCO32- + nHCO3- => (2) Giải (1) và (2) thu được a và b *Nhỏ từ từ HCl vào dd X (CO32- và HCO3-) Thứ tự phản ứng: H+ + CO32- → HCO3- H+ + HCO3- → H2O + CO2 Lời giải chi tiết : Giả sử hấp thụ CO2 vào dung dịch NaOH và Na2CO3 thu được CO32- (a mol) và HCO3- (b mol) BTNT “C”: nCO2 + nNa2CO3 = nCO3 2- + nHCO3- => a + b = 0,1 + 0,1 => a + b = 0,2 (1) BTĐT: nNa+ = 2nCO32- + nHCO3- => 2a + b = 0,08 + 2.0,1 => 2a + b = 0,28 (2) Giải (1) và (2) thu được a = 0,08 và b = 0,12 mol *Nhỏ từ từ HCl vào dd X (0,08 mol CO32- và 0,12 mol HCO3-) Thứ tự phản ứng: H+ + CO32- → HCO3- 0,08← 0,08 H+ + HCO3- → H2O + CO2 0,08 ← 0,08 => nHCl = 0,08 + 0,08 = 0,16 mol Câu 25 : Tiến hành các thí nghiệm sau ở điều kiện thường: (a) Sục khí SO2 vào dung dịch H2S. (b) Sục khí F2 vào nước. (c) Cho KMnO4 vào dung dịch HCl đặc. (d) Sục khí CO2 vào dung dịch NaOH. (e) Cho Si vào dung dịch NaOH. (g) Cho Na2SO3 vào dung dịch H2SO4. (h) C + H2O(hơi) ở nhiệt độ cao. (i) Nung Cu(NO3)2. (k) Dẫn CO qua FeO nung nóng. Số thí nghiệm có sinh ra đơn chất là
Đáp án : C Phương pháp giải : Viết PTHH Chú ý: Đơn chất là các chất được tạo nên từ một nguyên tố. Lời giải chi tiết : (a) SO2 + 2H2S → 3S + 2H2O => tạo đơn chất S (b) 2F2 + 2H2O → 4HF + O2 => tạo đơn chất O2 (c) 2KMnO4 + 16HCl đặc → 2KCl + 2MnCl2 + 5Cl2 + 8H2O => tạo đơn chất Cl2 (d) CO2 + 2NaOH → Na2CO3 + H2O CO2 + NaOH → NaHCO3 => không tạo đơn chất (e) Si + 2NaOH + H2O → Na2SiO3 + 2H2 => tạo đơn chất H2 (g) Na2SO3 + H2SO4 → Na2SO4 + H2O + CO2 => không tạo đơn chất (h) C + H2O → CO + H2 C + 2H2O → CO2 + 2H2 => tạo đơn chất H2 (i) 2Cu(NO3)2 \(\xrightarrow{{{t}^{o}}}\) 2CuO + 4NO2 + O2 => tạo đơn chất O2 (k) CO + FeO \(\xrightarrow{{{t}^{o}}}\) Fe + CO2 => tạo đơn chất Fe Vậy các phản ứng sinh ra đơn chất là: a, b, c, e, h, i, k
|