Trắc nghiệm Bài 17. Biến thiên enthalpy trong các phản ứng hóa học - Hóa 10 Kết nối tri thứcĐề bài Câu 1 : Phản ứng nào sau đây là phản ứng tỏa nhiệt?
Câu 2 : Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?
Câu 3 : Nung KNO3 lên 550oC xảy ra phản ứng: KNO3(s) → KNO2(s) + ½ O2(g) ∆H Phản ứng nhiệt phân KNO3 là
Câu 4 : Cho phản ứng hóa học xảy ra ở điều kiện tiêu chuẩn sau: 2NO2(g) (đỏ nâu) → N2O4(g) (không màu) Biết NO2 và N2O4 có \({\Delta _f}H_{298}^o\) tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Điều này chứng tỏ phản ứng
Câu 5 : Nung nóng hai ống nghiệm chứa NaHCO3 và P, xảy ra các phản ứng sau: 2NaHCO3(s) → Na2CO3(s) + CO2(g) + H2O(g) (1) 4P(s) + 5O2(g) → 2P2O5(s) (2) Khi ngừng đun nóng, phản ứng (1) dừng lại còn phản ứng (2) tiếp tục xảy ra, chứng tỏ
Câu 6 : Tiến hành quá trình ozone hóa 100 g oxi theo phản ứng sau: 3O2(g) (oxygen) → 2O3 (g) (ozone) Hỗn hợp thu được có chứa 24% ozone về khối lượng, tiêu tốn 71,2 kJ. Nhiệt tạo thành \({\Delta _f}H_{298}^o\) của ozone (kJ/mol) có giá trị là
Câu 7 : Cho phản ứng hydrogen hóa ethylene: H2C=CH2(g) + H2(g) → H3C-CH3(g) Biết năng lượng liên kết trong các chất cho trong bảng sau:
Biến thiên enthalpy (kJ) của phản ứng có giá trị là
Câu 8 : Cho phương trình phản ứng sau: 2H2(g) + O2(g) → 2H2O(l) ∆H = -572 kJ Khi cho 2 g khí H2 tác dụng hoàn toàn với 32g khí O2 thì phản ứng
Câu 9 : Phát biểu nào sau đây không đúng?
Câu 10 : Cho phương trình phản ứng Zn(r) + CuSO4(aq) → ZnSO4(aq) + Cu(r) ∆H = -210 kJ và các phát biểu sau: (1) Zn bị oxi hóa (2) Phản ứng trên tỏa nhiệt (3) Biến thiên enthalpy của phản ứng tạo thành 3,84 g Cu là +12,6 kJ (4) Trong quá trình phản ứng, nhiệt độ hỗn hợp tăng lên Các phát biểu đúng là
Câu 11 : Trong các phát biểu sau đây có bao nhiêu phát biểu đúng? (1) Phản ứng thu nhiệt xảy ra thuận lợi hơn so với phản ứng tỏa nhiệt. (2) Giá trị hiệu ứng nhiệt của phản ứng tỏa nhiệt trái dấu với phản ứng thu nhiệt. (3) Phản ứng thu nhiệt thường phải cung cấp nhiệt độ liên tục trong quá trình phản ứng. (4) Biến thiên enthalpy \({\Delta _r}{\rm{H}}_{298}^0\) của phản ứng xảy ra trong quá trình đẳng áp và điều kiện chuẩn. (5) Khi cho vôi sống vào nước thấy nhiệt độ tăng so với ban đầu chứng tỏ đây là phản ứng tỏa nhiệt
Câu 12 : Dựa vào phương trình nhiệt hoá học của phản ứng sau: 3Fe (s) + 4H2O (l) → Fe3O4 (s) + 4H2 (g) \({\Delta _r}H_{298}^0\)= +26,32 kJ Giá trị \({\Delta _r}H_{298}^0\) của phản ứng: Fe3O4 (s) + 4H2 (g) → 3Fe (s) + 4H2O (l) là
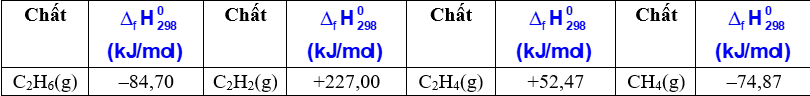
Câu 13 : Dựa vào bảng enthalpy tạo thành chuẩn của 1 số chất dưới đây, thứ tự tăng dần độ bền nhiệt các khísau đây: (1) CH4 (g); (2) C2H6 (g); (3) C2H2 (g) và (4) C2H4 (g) là:
Câu 14 : Biết nhiệt tạo thành \({\Delta _f}H_{298}^0\)của FeS2(s), Fe2O3(s) và SO2(g) lần lượt là –177,9 kJ/mol, –825,5 kJ/mol và –296,8 kJ/mol, cho phản ứng sau đây \(4Fe{S_2} + 11{O_2} \to 2F{e_2}{O_3} + 8S{O_2}\). Phát biểu nào sau đây đúng ?
Câu 15 : Phản ứng thế của methane với chlorine để thu được methyl chloride : CH4 (g) + Cl2 (g) → CH3Cl (g) + HCl \({\Delta _r}H_{298}^0\)= -110 kJ. Biết năng lượng liên kết (kJ/mol) của C–H, Cl–Cl, H–Cl lần lượt là 418, 243 và 432. Năng lượng liên kết của C – Cl trong methyl chloride là
Câu 16 : Cho hai phản ứng cùng xảy ra ở điều kiện chuẩn: (1) N2(g) + O2(g) ⟶ 2NO(g) \({\Delta _r}H_{298\;(1)}^0\) (2) NO(g) + \(\frac{1}{2}\)O2(g) ⟶ NO2(g) \({\Delta _r}H_{298\;(2)}^0\) Trong các phát biểu sau đây có bao nhiêu phát biểu không đúng? (1) Enthalpy tạo thành chuẩn của NO là \(\frac{1}{2}{\Delta _r}H_{298\;(1)}^0\)kJ mol−1. (2) Enthalpy tạo thành chuẩn của NO2 là \({\Delta _r}H_{298\;(2)}^0\) kJ mol−1. (3) Biến thiên enthalpy chuẩn của phản ứng giữa 1 mol N2 với 1 mol O2 tạo thành 2 mol NO là \(\frac{1}{2}{\Delta _r}H_{298\;(1)}^0\)kJ mol−1. (4) Biến thiên enthalpy chuẩn của phản ứng giữa 1 mol khí NO với 0,5 mol khí O2 tạo thành 1 mol khí NO2 là \({\Delta _r}H_{298\;(2)}^0\)kJ. (5) Enthalpy tạo thành chuẩn của NO2 (g) là: \(\frac{1}{2}{\Delta _r}H_{298\;(1)}^0 + {\Delta _r}H_{298\;(2)}^0\) (kJ mol−1)
Câu 17 : Cho các phát biểu sau : (1) Phản ứng đốt cháy cồn dễ thực hiện hơn phản ứng nung vôi (2) Nhiên liệu cháy ở trên vùng cao nhanh hơn khi cháy ở vùng thấp. (3) Có 3 đơn chất có \({\Delta _f}H_{298}^0\)= 0 trong dãy sau : C (graphite, s), Br2 (l), Br2(g), Na (s), Na (g), Hg (l), Hg (s). (4) Nước đóng băng ở Bắc cực và Nam cực là quá trình tỏa nhiệt. Số phát biểu đúng là
Câu 18 : Calcium oxide (CaO) đã phản với nước trong một cốc chịu nhiệt theo phương trình: CaO + H2O →Ca(OH)2. Ghi nhận giá trị nhiệt độ sau khoảng 2 phút thấy nhiệt độ chất lỏng trong cốc tăng lên từ 25oC đến 50oC. Kết luận nào sau đây là đúng ?
Câu 19 : Cho phương trình nhiệt hoá học của phản ứng: N2 (g) + O2 (g) → 2NO (g) \({\Delta _r}H_{298}^0\)= + 179,20 kJ Phản ứng trên là phản ứng
Câu 20 : Cho phản ứng sau : KNO3(s) → KNO2(s) + \(\frac{1}{2}\)O2(g) \({\Delta _r}H_{298}^{0.}\). Biểu thức đúng tính\({\Delta _r}H_{298}^{0.}\) của phản ứng theo giá trị enthalpy tạo thành chuẩn của các chất là :
Câu 21 : Cho các phản ứng sau: (1) C (s) + CO2(g) → 2CO(g) \({\Delta _r}H_{298}^0\)= 173,6 kJ (2) C(s) + H2O(g) → CO(g) + H2(g) \({\Delta _r}H_{298}^0\) = 133.8 kJ (3) CO(g) + H2O(g) → CO2(g) + H2(g) Ở 500 K, 1 atm, biến thiên enthalpy của phản ứng (3) có giá trị là
Lời giải và đáp án Câu 1 : Phản ứng nào sau đây là phản ứng tỏa nhiệt?
Đáp án : C Phương pháp giải : - Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt - Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt Lời giải chi tiết : Oxi hóa glucose thành CO2 và H2O, tương tự phản ứng đốt cháy glucose là phản ứng tỏa nhiệt Câu 2 : Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?
Đáp án : C Lời giải chi tiết : Phản ứng A, B, D đều cần đốt cháy để xảy ra Phản ứng C có thể xảy ra ở điều kiện thường Câu 3 : Nung KNO3 lên 550oC xảy ra phản ứng: KNO3(s) → KNO2(s) + ½ O2(g) ∆H Phản ứng nhiệt phân KNO3 là
Đáp án : B Phương pháp giải : - Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt (∆H < 0) - Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt (∆H > 0) Lời giải chi tiết : Phản ứng xảy ra ở nhiệt độ cao => Phản ứng thu nhiệt => ∆H > 0 Câu 4 : Cho phản ứng hóa học xảy ra ở điều kiện tiêu chuẩn sau: 2NO2(g) (đỏ nâu) → N2O4(g) (không màu) Biết NO2 và N2O4 có \({\Delta _f}H_{298}^o\) tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Điều này chứng tỏ phản ứng
Đáp án : C Phương pháp giải : Áp dụng công thức: \({\Delta _r}H_{298}^o\) = \(\sum {{\Delta _f}H_{298}^o} (sp) - \sum {{\Delta _f}H_{298}^o} (c{\text{d}})\) Lời giải chi tiết : \({\Delta _r}H_{298}^o\) = \(\sum {{\Delta _f}H_{298}^o} (sp) - \sum {{\Delta _f}H_{298}^o} (c{\text{d}})\) = 9,16 - 2.33,18 = -57,2 kJ/mol < 0 => Phản ứng tỏa nhiệt, N2O4 bền vững hơn NO2 Câu 5 : Nung nóng hai ống nghiệm chứa NaHCO3 và P, xảy ra các phản ứng sau: 2NaHCO3(s) → Na2CO3(s) + CO2(g) + H2O(g) (1) 4P(s) + 5O2(g) → 2P2O5(s) (2) Khi ngừng đun nóng, phản ứng (1) dừng lại còn phản ứng (2) tiếp tục xảy ra, chứng tỏ
Đáp án : B Phương pháp giải : (1) cần cung cấp nhiệt độ mới xảy ra phản ứng (2) không cần cung cấp nhiệt độ Lời giải chi tiết : - Phản ứng (1) cần cung cấp nhiệt mới xảy ra phản ứng => Phản ứng thu nhiệt - Phản ứng (2) không cần cung cấp nhiệt vẫn xảy ra phản ứng => Phản ứng tỏa nhiệt Câu 6 : Tiến hành quá trình ozone hóa 100 g oxi theo phản ứng sau: 3O2(g) (oxygen) → 2O3 (g) (ozone) Hỗn hợp thu được có chứa 24% ozone về khối lượng, tiêu tốn 71,2 kJ. Nhiệt tạo thành \({\Delta _f}H_{298}^o\) của ozone (kJ/mol) có giá trị là
Đáp án : A Phương pháp giải : - Tính số mol O3 - Tính: \({\Delta _r}H_{298}^o\) - \({\Delta _r}H_{298}^o\) = \(\sum {{\Delta _f}H_{298}^o} (sp) - \sum {{\Delta _f}H_{298}^o} (c{\text{d}})\) Lời giải chi tiết :
Câu 7 : Cho phản ứng hydrogen hóa ethylene: H2C=CH2(g) + H2(g) → H3C-CH3(g) Biết năng lượng liên kết trong các chất cho trong bảng sau:
Biến thiên enthalpy (kJ) của phản ứng có giá trị là
Đáp án : B Phương pháp giải : \({\Delta _r}H_{298}^o\) = \(\sum {{E_b}} (cd) - \sum {{E_b}} (sp)\) Lời giải chi tiết : \({\Delta _r}H_{298}^o\) = \(\sum {{E_b}} (cd) - \sum {{E_b}} (sp)\) = EC2H4 + EH2 – EC2H6 = EC=C + 4.EC-H + EH-H – EC-C – 6.EC-H = 612 + 4.418 + 436 – 346 – 6.418 = -134 Câu 8 : Cho phương trình phản ứng sau: 2H2(g) + O2(g) → 2H2O(l) ∆H = -572 kJ Khi cho 2 g khí H2 tác dụng hoàn toàn với 32g khí O2 thì phản ứng
Đáp án : A Phương pháp giải : ∆H < 0: Phản ứng tỏa nhiệt ∆H > 0: Phản ứng thu nhiệt Lời giải chi tiết : - Ta có ∆H < 0 => Phản ứng tỏa nhiệt - Nhiệt hình thành là nhiệt lượng tỏa ra hay thu vào khi hình thành 1 mol chất sản phẩm => Phản ứng hình thành 1 mol H2O tỏa ra nhiệt lượng 572 kJ Câu 9 : Phát biểu nào sau đây không đúng?
Đáp án : D Lời giải chi tiết : Các phản ứng tỏa nhiệt như CO2 + CaO → CaCO3, phản ứng lên men,… khó xảy ra hơn khi đun nóng Câu 10 : Cho phương trình phản ứng Zn(r) + CuSO4(aq) → ZnSO4(aq) + Cu(r) ∆H = -210 kJ và các phát biểu sau: (1) Zn bị oxi hóa (2) Phản ứng trên tỏa nhiệt (3) Biến thiên enthalpy của phản ứng tạo thành 3,84 g Cu là +12,6 kJ (4) Trong quá trình phản ứng, nhiệt độ hỗn hợp tăng lên Các phát biểu đúng là
Đáp án : C Lời giải chi tiết : Phát biểu (3) sai: Biến thiên enthalpy của phản ứng tạo thành 3,84 g Cu là: -210.3,84/64 = -12,6 kJ Câu 11 : Trong các phát biểu sau đây có bao nhiêu phát biểu đúng? (1) Phản ứng thu nhiệt xảy ra thuận lợi hơn so với phản ứng tỏa nhiệt. (2) Giá trị hiệu ứng nhiệt của phản ứng tỏa nhiệt trái dấu với phản ứng thu nhiệt. (3) Phản ứng thu nhiệt thường phải cung cấp nhiệt độ liên tục trong quá trình phản ứng. (4) Biến thiên enthalpy \({\Delta _r}{\rm{H}}_{298}^0\) của phản ứng xảy ra trong quá trình đẳng áp và điều kiện chuẩn. (5) Khi cho vôi sống vào nước thấy nhiệt độ tăng so với ban đầu chứng tỏ đây là phản ứng tỏa nhiệt
Đáp án : B Phương pháp giải : Dựa vào ý nghĩa của biến thiên enthalpy Lời giải chi tiết : (1) sai, vì phản ứng thu nhiệt cần cung cấp nhiệt độ trong suốt quá trình xảy ra (2) đúng (3) đúng (4) đúng (5) đúng Đáp án B Câu 12 : Dựa vào phương trình nhiệt hoá học của phản ứng sau: 3Fe (s) + 4H2O (l) → Fe3O4 (s) + 4H2 (g) \({\Delta _r}H_{298}^0\)= +26,32 kJ Giá trị \({\Delta _r}H_{298}^0\) của phản ứng: Fe3O4 (s) + 4H2 (g) → 3Fe (s) + 4H2O (l) là
Đáp án : A Phương pháp giải : Phản ứng thuận là phản ứng tỏa nhiệt thì phản ứng nghịch là phản ứng thu nhiệt và ngược lại Lời giải chi tiết : 3Fe (s) + 4H2O (l) → Fe3O4 (s) + 4H2 (g) \({\Delta _r}H_{298}^0\)= +26,32 kJ => Fe3O4 (s) + 4H2 (g) → 3Fe (s) + 4H2O (l) có \({\Delta _r}H_{298}^0\) = -26,32 KJ Đáp án A Câu 13 : Dựa vào bảng enthalpy tạo thành chuẩn của 1 số chất dưới đây, thứ tự tăng dần độ bền nhiệt các khísau đây: (1) CH4 (g); (2) C2H6 (g); (3) C2H2 (g) và (4) C2H4 (g) là:
Đáp án : B Phương pháp giải : Giá trị enthalpy càng âm chất càng bền nhiệt và ngược lại Lời giải chi tiết : Dựa vào bảng enthalpy: (3) < (4) < (2) < (1). Đáp án B Câu 14 : Biết nhiệt tạo thành \({\Delta _f}H_{298}^0\)của FeS2(s), Fe2O3(s) và SO2(g) lần lượt là –177,9 kJ/mol, –825,5 kJ/mol và –296,8 kJ/mol, cho phản ứng sau đây \(4Fe{S_2} + 11{O_2} \to 2F{e_2}{O_3} + 8S{O_2}\). Phát biểu nào sau đây đúng ?
Đáp án : C Phương pháp giải : Dưa vào nhiệt tạo thành của các chất và tính giá trị biến thiên enthalpy của phản ứng Lời giải chi tiết : \(\begin{array}{l}{\Delta _r}H_{298}^o = 2{\Delta _f}H_{298}^o(F{e_2}{O_3}) + 8.{\Delta _f}H_{298}^o(S{O_2}) - 4.{\Delta _f}H_{298}^o(Fe{S_2})\\ = 2. - 825,5 + 8. - 296,8 - 4.( - 177,9) = - 3313,8kJ\end{array}\) => Phản ứng tỏa nhiệt xảy ra thuận lợi => Phản ứng trên tỏa ra nhiệt lượng bằng 3313,8Kj => tổng nhiệt tạo thành của chất tham gia lớn hơn sản phẩm Đáp án C Câu 15 : Phản ứng thế của methane với chlorine để thu được methyl chloride : CH4 (g) + Cl2 (g) → CH3Cl (g) + HCl \({\Delta _r}H_{298}^0\)= -110 kJ. Biết năng lượng liên kết (kJ/mol) của C–H, Cl–Cl, H–Cl lần lượt là 418, 243 và 432. Năng lượng liên kết của C – Cl trong methyl chloride là
Đáp án : D Phương pháp giải : Dựa vào năng lượng liên kết của chất để tính biến thiên enthalpy Lời giải chi tiết : \(\begin{array}{l}{\Delta _r}H_{298}^o = 4{E_{C - H}} + {E_{Cl - Cl}} - 3{E_{C - H}} - {E_{C - Cl}} - {E_{H - Cl}}\\ \Rightarrow 4.418 + 243 - 3.418 - {E_{C - Cl}} - 432 = - 110\\ \Rightarrow {E_{C - Cl}} = 339kJ/mol\end{array}\) Đáp án D Câu 16 : Cho hai phản ứng cùng xảy ra ở điều kiện chuẩn: (1) N2(g) + O2(g) ⟶ 2NO(g) \({\Delta _r}H_{298\;(1)}^0\) (2) NO(g) + \(\frac{1}{2}\)O2(g) ⟶ NO2(g) \({\Delta _r}H_{298\;(2)}^0\) Trong các phát biểu sau đây có bao nhiêu phát biểu không đúng? (1) Enthalpy tạo thành chuẩn của NO là \(\frac{1}{2}{\Delta _r}H_{298\;(1)}^0\)kJ mol−1. (2) Enthalpy tạo thành chuẩn của NO2 là \({\Delta _r}H_{298\;(2)}^0\) kJ mol−1. (3) Biến thiên enthalpy chuẩn của phản ứng giữa 1 mol N2 với 1 mol O2 tạo thành 2 mol NO là \(\frac{1}{2}{\Delta _r}H_{298\;(1)}^0\)kJ mol−1. (4) Biến thiên enthalpy chuẩn của phản ứng giữa 1 mol khí NO với 0,5 mol khí O2 tạo thành 1 mol khí NO2 là \({\Delta _r}H_{298\;(2)}^0\)kJ. (5) Enthalpy tạo thành chuẩn của NO2 (g) là: \(\frac{1}{2}{\Delta _r}H_{298\;(1)}^0 + {\Delta _r}H_{298\;(2)}^0\) (kJ mol−1)
Đáp án : B Lời giải chi tiết : (1) đúng (2) sai vì enthalpy tạo thành chuẩn của NO2 phải được tạo thành từ N2 và O2 (3) sai vì biến thiên enthalpy tạo thành chuẩn được xét ở 1 mol (4) đúng Đáp án B Câu 17 : Cho các phát biểu sau : (1) Phản ứng đốt cháy cồn dễ thực hiện hơn phản ứng nung vôi (2) Nhiên liệu cháy ở trên vùng cao nhanh hơn khi cháy ở vùng thấp. (3) Có 3 đơn chất có \({\Delta _f}H_{298}^0\)= 0 trong dãy sau : C (graphite, s), Br2 (l), Br2(g), Na (s), Na (g), Hg (l), Hg (s). (4) Nước đóng băng ở Bắc cực và Nam cực là quá trình tỏa nhiệt. Số phát biểu đúng là
Đáp án : A Phương pháp giải : Dựa vào phản ứng tỏa nhiệt và phản ứng thu nhiệt Lời giải chi tiết : (1) đúng (2) sai vì trên cao nồng độ O2 thấp hơn nên quá trình cháy xảy ra chậm hơn (3) sai vì tất cả đơn chất đều có enthalpy tạo thành chuẩn bằng 0 (4) đúng Đáp án A Câu 18 : Calcium oxide (CaO) đã phản với nước trong một cốc chịu nhiệt theo phương trình: CaO + H2O →Ca(OH)2. Ghi nhận giá trị nhiệt độ sau khoảng 2 phút thấy nhiệt độ chất lỏng trong cốc tăng lên từ 25oC đến 50oC. Kết luận nào sau đây là đúng ?
Đáp án : D Phương pháp giải : Dựa vào thông tin nhiệt độ tăng trong cốc sau 2 phút Lời giải chi tiết : Nhiệt độ trong cốc tăng nên đây là phản ứng tỏa nhiệt Đáp án D Câu 19 : Cho phương trình nhiệt hoá học của phản ứng: N2 (g) + O2 (g) → 2NO (g) \({\Delta _r}H_{298}^0\)= + 179,20 kJ Phản ứng trên là phản ứng
Đáp án : A Phương pháp giải : Dựa vào\({\Delta _r}H_{298}^0\)của phản ứng Lời giải chi tiết : Phản ứng trên có \({\Delta _r}H_{298}^0\)= + 179,20 Kj > 0 => Phản ứng thu nhiệt và hấp thu 179,20 KJ nhiệt Đáp án A Câu 20 : Cho phản ứng sau : KNO3(s) → KNO2(s) + \(\frac{1}{2}\)O2(g) \({\Delta _r}H_{298}^{0.}\). Biểu thức đúng tính\({\Delta _r}H_{298}^{0.}\) của phản ứng theo giá trị enthalpy tạo thành chuẩn của các chất là :
Đáp án : D Phương pháp giải : Dựa vào công thức tính \({\Delta _r}H_{298}^{0.}\) của phản ứng Lời giải chi tiết : \({\Delta _r}H_{298}^0 = \;{\Delta _f}H_{298}^0\;\left( {KN{O_2}(s)} \right)\;{\rm{ + }}\frac{1}{2} \times {\Delta _f}H_{298}^0\left( {{O_2}(g)} \right) - {\Delta _f}H_{298}^0\;\left( {KN{O_3}(s)} \right)\) Đáp án D Câu 21 : Cho các phản ứng sau: (1) C (s) + CO2(g) → 2CO(g) \({\Delta _r}H_{298}^0\)= 173,6 kJ (2) C(s) + H2O(g) → CO(g) + H2(g) \({\Delta _r}H_{298}^0\) = 133.8 kJ (3) CO(g) + H2O(g) → CO2(g) + H2(g) Ở 500 K, 1 atm, biến thiên enthalpy của phản ứng (3) có giá trị là
Đáp án : A Phương pháp giải : Dựa vào biến thiên enthalpy của phản ứng (1), (2) từ đó xác định phản ứng (3) Lời giải chi tiết : \(\begin{array}{l}{\Delta _r}H_{298}^o(3) = {\Delta _r}H_{298}^o(2) + ( - {\Delta _r}H_{298}^o(1))\\ = 133,8 + ( - 173,6) = - 39,8kJ\end{array}\) Đáp án A |