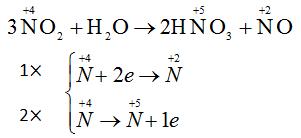Trắc nghiệm Bài 12. Phản ứng oxi hóa - khử và ứng dụng trong cuộc sống - Hóa 10 Chân trời sáng tạoĐề bài Câu 1 : Số oxi hóa của nitơ trong NH4+ , NO2- , và HNO3 lần lượt là:
Câu 2 : Số oxi hóa của Mn, Fe trong Fe3+ , S trong SO3 , P trong PO43-lần lượt là:
Câu 3 : Phản ứng nào là phản ứng oxi hoá - khử?
Câu 4 : Ở phản ứng nào NH3 không đóng vai trò chất khử ?
Câu 6 : Phản ứng nào là phản ứng oxi hoá - khử?
Câu 7 : Cho sơ đồ phản ứng : \(F{e_3}{O_4} + HN{O_3} \to Fe{\left( {N{O_3}} \right)_3} + NO + {H_2}O\) Cân bằng PTHH của phản ứng trên. Các hệ số tương ứng với phân tử các chất là dãy số nào sau đây ?
Câu 8 : Trong phản ứng đốt cháy \(CuFeS_2\) tạo ra sản phẩm \(CuO, Fe_2O_3\) và \(SO_2\) thì một phân tử \(CuFeS_2\) sẽ
Câu 9 : Cho phản ứng : M2Ox + HN03 —> M(NO3)3 + ... Khi x có giá trị là bao nhiêu thì phản ứng trên không thuộc loại phản ứng oxi hoá - khử ?
Câu 10 : Trong phản ứng: \(C{l_2} + {H_2}O \to HCl + HClO\), các nguyên tử Cl
Lời giải và đáp án Câu 1 : Số oxi hóa của nitơ trong NH4+ , NO2- , và HNO3 lần lượt là:
Đáp án : B Phương pháp giải : Trong hầu hết các hợp chất lấy H có hóa trị I => số oxi hóa là +1 O có hóa trị II => số oxi hóa là -2 Tất cả các kim loại kiềm, kiềm thổ có hóa trị ứng với số nhóm trong bảng tuần hoàn => có số oxi hóa + 1; + 2 Nguyên tử luôn trung hòa về điện => tổng số oxi hóa của các chất trong phân tử = 0 => từ đó tính được số oxi hóa của các chất chưa biết. Lời giải chi tiết : Gọi số oxi hóa của N trong các hợp chất là x Ta có: NH4+: x + 4 = 1 \( \to\) x = -3 \( \to\) số oxi hóa của N trong NH4+ là -3 NO2-: x + 2.(-2) = -1 \( \to\) x = 3 \( \to\) số oxi hóa của N trong NO2- là +3 HNO3: 1 + x + 3.(-2) = 0 \( \to\) x = 5 \( \to\) số oxi hóa của N trong HNO3 là +5 Câu 2 : Số oxi hóa của Mn, Fe trong Fe3+ , S trong SO3 , P trong PO43-lần lượt là:
Đáp án : A Phương pháp giải : Trong hầu hết các hợp chất lấy H có hóa trị I => số oxi hóa là +1 O có hóa trị II => số oxi hóa là -2 Tất cả các kim loại kiềm, kiềm thổ có hóa trị ứng với số nhóm trong bảng tuần hoàn => có số oxi hóa + 1; + 2 Nguyên tử luôn trung hòa về điện => tổng số oxi hóa của các chất trong phân tử = 0 => từ đó tính được số oxi hóa của các chất chưa biết. Lời giải chi tiết : Mn là đơn chất nên có số oxi hóa 0 Fe3+ có số oxi hóa +3 SO3: x + 3.(-2) = 0 \( \to\) x = 6 \( \to\) số oxi hóa của S là +6 PO43-: x + 4.(-2) = -3 \( \to\) x = 5 \( \to\) số oxi hóa của P là +5 Câu 3 : Phản ứng nào là phản ứng oxi hoá - khử?
Đáp án : A Phương pháp giải : Phản ứng oxi hóa khử là phản ứng hóa học trong đó đồng thời xảy ra sự oxi hóa và sự khử. Tức số oxi hóa của các chất trước và sau phản ứng thay đổi. Lời giải chi tiết : Những phản ứng theo đề bài cho, phản ứng oxi hóa khử là \(2HgO\xrightarrow{{{t^0}}}2Hg + {O_2}\) Hg2+ + 2e \( \to\) Hg0 2O2- \( \to\) O2 + 4e Còn các phản ứng khác không phải là phản ứng oxi hóa khử Câu 4 : Ở phản ứng nào NH3 không đóng vai trò chất khử ?
Đáp án : D Phương pháp giải : NH3 đóng vai trò là chất khử khi số oxi hóa của NH3 tăng sau phản ứng => các phản ứng còn lại NH3 sẽ đóng vai trò là chất oxi hóa Lời giải chi tiết : A,B,C số oxi hóa của NH3 đều tăng sau phản ứng => đóng vai trò là chất khử => ở phản ứng D NH3 đóng vai trò là môi trường
Đáp án : C Phương pháp giải : Chất oxi hóa là chất nhận e (tham gia quá trình khử) Chất khử là chất cho e (tham gia quá trình oxi hóa) Lời giải chi tiết : NO2 đóng vai trò vừa là chất oxi hoá vừa là chất khử
Quá trình 1 là quá trình khử Quá trình 2 là quá trình oxi hóa Câu 6 : Phản ứng nào là phản ứng oxi hoá - khử?
Đáp án : C Phương pháp giải : Phản ứng oxi hóa khử là phản ứng hóa học trong đó đồng thời xảy ra sự oxi hóa và sự khử( tức các chất có sự thay đổi số oxi hóa trước và sau phản ứng) => tìm ra được phản ứng oxi hóa khử. Lời giải chi tiết : Trong các phản ứng trên chi có phản ứng C là phản ứng oxi hoá - khử vì có sự thay đổi số oxi hoá của các nguyên tố.
Câu 7 : Cho sơ đồ phản ứng : \(F{e_3}{O_4} + HN{O_3} \to Fe{\left( {N{O_3}} \right)_3} + NO + {H_2}O\) Cân bằng PTHH của phản ứng trên. Các hệ số tương ứng với phân tử các chất là dãy số nào sau đây ?
Đáp án : B Phương pháp giải : Cân bằng PTHH theo phương pháp thăng bằng electron Lời giải chi tiết :
\(3F{e_3}{O_4} + 28HN{O_3} \to 9Fe{\left( {N{O_3}} \right)_3} + NO + 14{H_2}O\) Câu 8 : Trong phản ứng đốt cháy \(CuFeS_2\) tạo ra sản phẩm \(CuO, Fe_2O_3\) và \(SO_2\) thì một phân tử \(CuFeS_2\) sẽ
Đáp án : C Phương pháp giải : Viết quá trình oxi hóa của \(CuFeS_2\) Lời giải chi tiết : \(\mathop {CuFe{S_2}}\limits^0 \to \mathop {Cu}\limits^{ + 2} + \mathop {Fe}\limits^{ + 3} + 2\mathop S\limits^{ + 4} + 13e\) => 1 phân tử \(CuFeS_2\) nhường 13e Câu 9 : Cho phản ứng : M2Ox + HN03 —> M(NO3)3 + ... Khi x có giá trị là bao nhiêu thì phản ứng trên không thuộc loại phản ứng oxi hoá - khử ?
Đáp án : D Phương pháp giải : Để phản ứng không là phản ứng oxi hóa khử khi số oxi hóa của các nguyên tố trong phản ứng không thay đổi Lời giải chi tiết : Vì x = 3 thì số oxi hóa của M trước và sau phản ứng không thay đổi vẫn là +3 Câu 10 : Trong phản ứng: \(C{l_2} + {H_2}O \to HCl + HClO\), các nguyên tử Cl
Đáp án : C Phương pháp giải : Xác định số oxi hóa của Cl trước và sau phản ứng Số oxi hóa tăng => Chất khử, bị oxi hóa Số oxi hóa giảm => Chất oxi hóa, bị khử Lời giải chi tiết : Ta có: \({\mathop {Cl_2}\limits^0} + {H_2}O \to H\mathop {Cl}\limits^{ - 1} + H\mathop {Cl}\limits^{ + 1} O\) Số oxi hóa của Cl vừa tăng, vừa giảm => Cl vừa bị oxi hoá, vừa bị khử. |