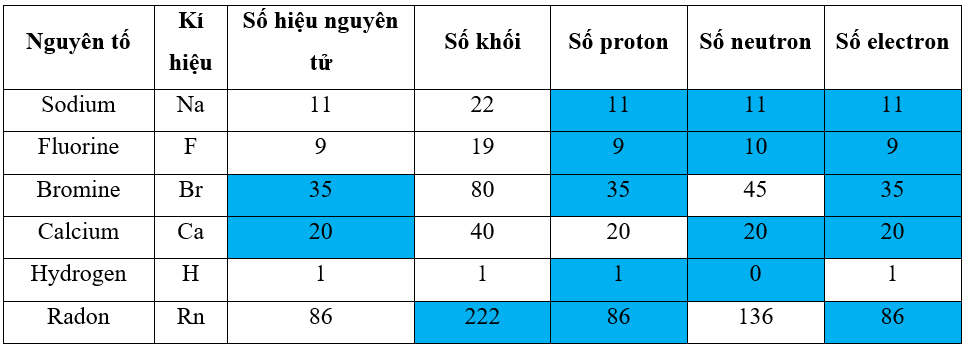
Bài 3. Nguyên tố hóa học trang 11, 12, 13 SBT Hóa 10 Chân trời sáng tạoCho các phát biểu sau: (1) Trong một nguyên tử luôn có số proton bằng số electron và bằng số đơn vị điện tích hạt nhân. (2) Tổng số proton và số electron trong một hạt nhân được gọi là số khối Cho các phát biểu sau, phát biểu nào đúng về đồng vị? A. Những phân tử có cùng số hạt proton nhưng khác nhau về số hạt neutron là đồng vị của nhau. B. Những ion có cùng số hạt proton nhưng khác nhau về số hạt electron là đồng vị của nhau. C. Những chất có cùng số hạt proton nhưng khác nhau về số Tổng hợp đề thi giữa kì 2 lớp 10 tất cả các môn - Chân trời sáng tạo Toán - Văn - Anh - Lí - Hóa - Sinh Lựa chọn câu để xem lời giải nhanh hơn 3.1 Cho các phát biểu sau: (1) Trong một nguyên tử luôn có số proton bằng số electron và bằng số đơn vị điện tích hạt nhân. (2) Tổng số proton và số electron trong một hạt nhân được gọi là số khối. (3) Số khối là khối lượng tuyệt đối của nguyên tử. (4) Số proton bằng số đơn vị điện tích hạt nhân. (5) Đồng vị là các nguyên tố có cùng số proton nhưng khác nhau về số neutron. Số phát biểu không đúng là A. 1. B. 2. C. 3. D. 4. Phương pháp giải: Dựa vào các kiến thức trong bài 3. Nguyên tố hóa học - Trong một nguyên tử luôn có số proton bằng số electron và bằng số đơn vị điện tích hạt nhân (+Z) - Số khối (A) là tổng số hạt proton và số hạt neutron trong hạt nhân - Số khối là khối lượng tương đối của nguyên tử - Đồng vị là các nguyên tử có cùng số proton nhưng khác nhau về số neutron Lời giải chi tiết: - Đáp án: C (1) Trong một nguyên tử luôn có số proton bằng số electron và bằng số đơn vị điện tích hạt nhân. => Đúng (2) Tổng số proton và số electron trong một hạt nhân được gọi là số khối. => Sai ở “số electron”, sửa thành “số neutron” (3) Số khối là khối lượng tuyệt đối của nguyên tử. => Sai ở “khối lượng tuyệt đối”, sửa thành “khối lượng tương đối”. Lưu ý: Khối lượng tuyệt đối của nguyên tử là tổng khối lượng của các hạt proton, neutron và electron trong nguyên tử (4) Số proton bằng số đơn vị điện tích hạt nhân. => Đúng (5) Đồng vị là các nguyên tố có cùng số proton nhưng khác nhau về số neutron. => Sai ở “các nguyên tố”, sửa thành “các nguyên tử” 3.2 Cho các phát biểu sau, phát biểu nào đúng về đồng vị? A. Những phân tử có cùng số hạt proton nhưng khác nhau về số hạt neutron là đồng vị của nhau. B. Những ion có cùng số hạt proton nhưng khác nhau về số hạt electron là đồng vị của nhau. C. Những chất có cùng số hạt proton nhưng khác nhau về số hạt neutron là đồng vị của nhau. D. Những nguyên tử có cùng số hạt proton nhưng khác nhau về số hạt neutron là đồng vị của nhau. Phương pháp giải: Dựa vào khái niệm của đồng vị: Các đồng vị của một nguyên tố hóa học là những nguyên tử có cùng số proton và khác nhau về số neutron Lời giải chi tiết: - Đáp án: D 3.3 Có những phát biểu sau đây về các đồng vị của một nguyên tố hoá học: (1) Các đồng vị có tính chất hoá học giống nhau. (2) Các đồng vị có tính chất vật lí khác nhau. (3) Các đồng vị có cùng số electron ở vỏ nguyên tử. (4) Các đồng vị có cùng số proton nhưng khác nhau về số khối. Trong các phát biểu trên, số phát biểu đúng là A. 1. B. 2. C. 3. D. 4. Phương pháp giải: Dựa vào đặc điểm của các đồng vị: - Các đồng vị có tính chất hoá học giống nhau. - Các đồng vị có tính chất vật lí khác nhau. - Các đồng vị có cùng số electron ở vỏ nguyên tử. - Các đồng vị có cùng số proton nhưng khác nhau về số khối. Lời giải chi tiết: - Đáp án: D (1) Các đồng vị có tính chất hoá học giống nhau. => Đúng (2) Các đồng vị có tính chất vật lí khác nhau. => Đúng (3) Các đồng vị có cùng số electron ở vỏ nguyên tử. => Đúng (4) Các đồng vị có cùng số proton nhưng khác nhau về số khối. => Đúng 3.4 Nguyên tử của nguyên tố A có 56 electron, trong hạt nhân có 81 neutron. Kí hiệu của nguyên tử nguyên tố A là A. \({}_{56}^{137}A\). B. \({}_{137}^{56}A\). C. \({}_{56}^{81}A\). D. \({}_{81}^{56}A\). Phương pháp giải: Dựa vào mối liên hệ giữa các hạt proton (p), electron (e) và neutron (n) - Số proton = số electron - Số khối A = p + n - Kí hiệu nguyên tử: \({}_Z^AX\) trong đó + X là kí hiệu nguyên tố hóa học + Z là số hiệu nguyên tử (= số proton) + A là số khối Lời giải chi tiết: - Gọi số hạt proton, electron và neutron trong A lần lượt là p, n, e - Có số proton = số electron = 56 - Số khối A = p + n = 56 + 81 = 137 - Vậy kí hiệu của nguyên tử nguyên tố A là \({}_{56}^{137}A\) => Đáp án: A 3.5 Trong tự nhiên, oxygen có 3 đồng vị là 16O, 17O, 18O. Có bao nhiêu loại phân tử O2? A. 3. B. 6. C. 9. D. 12. Phương pháp giải: Dựa vào định nghĩa về phân tử: Phân tử là 1 nhóm trung hòa điện tích có nhiều hơn 2 nguyên tử liên kết với nhau bằng các liên kết hóa học. Lời giải chi tiết: - Phân tử O2 được cấu tạo từ 2 nguyên tử O => Có tổng cộng 6 cách kết hợp để tạo thành phân tử O2 (1) 16O-16O (2) 16O-17O (3) 16O-18O (4) 17O-17O (5) 17O-18O (6) 18O-18O Đáp án: B 3.6 Có 3 nguyên tử: \({}_6^{12}X\), \({}_7^{14}Y\), \({}_6^{14}Z\). Những nguyên tử nào là đồng vị của một nguyên tố? A. X, Y. B. Y, Z. C. X, Z. D. X, Y, Z. Phương pháp giải: Dựa vào khái niệm của đồng vị: Các đồng vị của một nguyên tố hóa học là những nguyên tử có cùng số proton và khác nhau về số neutron => khác nhau về số khối A Lời giải chi tiết: - Nhận thấy nguyên tử X và nguyên tử Z có cùng số proton là 6 và khác nhau về số khối \({}_{}^{12}X\)và \({}_{}^{14}Z\)" Chỉ có X và Z là đồng vị của một nguyên tố => Đáp án: C 3.7 Boron có trong một số loại trái cây, thực phẩm mà chúng ta nạp vào cơ thể hằng ngày. Chúng có tác dụng rất tốt cho việc cải thiện một số chức năng của não bộ và cấu trúc, mật độ của xương. Nguyên tử boron có khối lượng nguyên tử là 10,801 amu. Tuy nhiên, không có nguyên tử boron nào có khối lượng chính xác là 10,801 amu. Hãy giải thích điều đó Phương pháp giải: Dựa vào : - Trạng thái tự nhiên của các nguyên tố: Trong tự nhiên, hầu hết các nguyên tố được tìm thấy dưới dạng hỗn hợp của các đồng vị - Công thức tính nguyên tử khối trung bình của nguyên tố X: \(\overline A {}_X = \frac{{{a_1}.A{}_1 + {a_2}.{A_2} + ... + {a_i}.{A_i}}}{{100}}\) Trong đó: + \(\overline A {}_X\)là nguyên tử khối trung bình của X + Ai là nguyên tử khối đồng vị thứ i + ai là tỉ lệ % số nguyên tử đồng vị thứ i Lời giải chi tiết: - Giải thích: Nguyên tử boron có khối lượng nguyên tử là 10,801 amu vì trong tự nhiên, hầu hết các nguyên tố được tìm thấy dưới dạng hỗn hợp của các đồng vị. - Đối với boron, các đồng vị của nguyên tố này là \({}^{11}B\)(chiếm 80,1%) và \({}^{10}B\)(chiếm 19,9%) " nguyên tử khối trung bình của Boron là \(\overline A {}_B = \frac{{80,1.11 + 19,9.10}}{{100}}\)=10,801 (amu) 3.8 Hoàn thành các thông tin trong bảng sau
Phương pháp giải: Dựa vào mối liên hệ giữa các hạt proton (p), electron (e) và neutron (n) - Số proton = số electron = số hiệu nguyên tử - Số khối A = p + n " n = A - p Lời giải chi tiết:
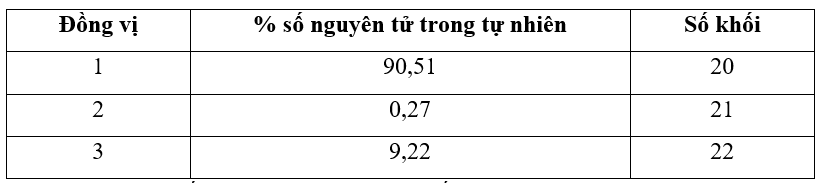
3.9 Một nguyên tố X tồn tại dưới dạng ba đồng vị tự nhiên có thông tin được cho trong bảng dưới đây:
Tính nguyên tử khối trung bình của nguyên tố X Phương pháp giải: Dựa vào công thức tính nguyên tử khối trung bình của nguyên tố X: \(\overline A {}_X = \frac{{{a_1}.A{}_1 + {a_2}.{A_2} + ... + {a_i}.{A_i}}}{{100}}\) Trong đó: + \(\overline A {}_X\)là nguyên tử khối trung bình của X + Ai là nguyên tử khối đồng vị thứ i + ai là tỉ lệ % số nguyên tử đồng vị thứ i Lời giải chi tiết: - Nguyên tử khối trung bình của nguyên tố X là: \(\overline A {}_X = \frac{{90,51.20 + 0,27.21 + 9,22.22}}{{100}}\)=20,1871 (amu) 3.10 Hoàn thành những thông tin còn thiếu trong bảng sau:
Phương pháp giải: Dựa vào mối liên hệ giữa các hạt proton (p), electron (e) và neutron (n) - Số proton = số electron - Số khối A = p + n - Kí hiệu nguyên tử: \({}_Z^AX\) trong đó + X là kí hiệu nguyên tố hóa học + Z là số hiệu nguyên tử (= số proton) + A là số khối Lời giải chi tiết:
3.11 Cho biết số proton, neutron và electron của nguyên tử \({}_{30}^{65}Zn\) Phương pháp giải: Dựa vào mối liên hệ giữa các hạt proton (p), electron (e) và neutron (n) - Số proton = số electron - Số khối A = p + n - Kí hiệu nguyên tử: \({}_Z^AX\) trong đó + X là kí hiệu nguyên tố hóa học + Z là số hiệu nguyên tử (= số proton) + A là số khối Lời giải chi tiết: - Có số hiệu nguyên tử của Zn là 30 " Số proton = số electron = 30 - Có số khối của Zn là 65 " 65 = p + n " n = 65 - p = 65 - 30 = 35 => Vậy nguyên tử Zn có 30 hạt proton, 30 hạt electron và 35 hạt neutron 3.12 Nguyên tử Mg có ba đồng vị ứng với thành phần phần trăm về số nguyên tử như sau:
Giả sử trong hỗn hợp nói trên có 50 nguyên tử 25Mg, số nguyên tử tương ứng của hai đồng vị 24Mg và 26Mg lần lượt là A. 389 và 56. B. 56 và 389. C. 495 và 56. D. 56 và 495. Phương pháp giải: Dựa vào công thức tính thành phần phần trăm số nguyên tử: % số nguyên tử AX = (Số nguyên tử AX/Tổng số nguyên tử X).100% Lời giải chi tiết: - Áp dụng công thức tính thành phần phần trăm số nguyên tử ta có: % số nguyên tử 25Mg = (Số nguyên tử 25Mg/Tổng số nguyên tử Mg).100% => Tổng số nguyên tử Mg = \(\frac{{100\% .50}}{{10,1\% }}\)= 495 (nguyên tử) - Số nguyên tử 24Mg = \(\frac{{78,6\% .495}}{{100\% }}\) = 389 (nguyên tử) - Số nguyên tử 26Mg = \(\frac{{11,3\% .495}}{{100\% }}\) = 56 (nguyên tử) => Đáp án: A 3.13 Hãy so sánh: a) Số lượng hợp chất và số lượng nguyên tố. b) Số lượng nguyên tố và số lượng đồng vị. Giải thích. Phương pháp giải: Dựa vào định nghĩa của hợp chất và đặc điểm của đồng vị: - Hợp chất là những chất tạo nên từ 2 nguyên tố hóa học trở lên - Trạng thái tự nhiên của các nguyên tố: Trong tự nhiên, hầu hết các nguyên tố được tìm thấy dưới dạng hỗn hợp của các đồng vị Lời giải chi tiết: a) - Cho đến hiện nay chỉ có 118 nguyên tố hóa học đã được tìm thấy - Hợp chất là những chất tạo nên từ 2 nguyên tố hóa học trở lên => Vậy nên số lượng hợp chất lớn hơn rất nhiều so với số lượng nguyên tố b) Vì trong tự nhiên, hầu hết các nguyên tố được tìm thấy dưới dạng hỗn hợp của các đồng vị ð Vậy nên số lượng nguyên tố nhỏ hơn so với số lượng các đồng vị 3.14 Oxide của kim loại M (M2O) được ứng dụng rất nhiều trong ngành hoá chất như sản xuất xi măng, sản xuất phân bón,... Trong sản xuất phân bón, chúng ta thường thấy M2O có màu trắng, tan nhiều trong nước và là thành phần không thể thiếu cho mọi loại cây trồng. Tổng số hạt cơ bản trong phân tử X có công thức M2O là 140, trong phân tử X có tổng số hạt mang điện nhiều hơn số hạt không mang điện là 44. Xác định công thức phân tử của M2O. Phương pháp giải: Dựa vào mối liên hệ giữa các hạt proton (p), neutron (n) và electron (e) trong nguyên tử: - Tổng số hạt trong nguyên tử = p + n + e - Trong nguyên tử trung hòa về điện có p = e - Số hạt không mang điện = n - Proton mang điện tích dương, electron mang điện tích âm Lời giải chi tiết: - Gọi số hạt proton, electron và neutron trong nguyên tử M lần lượt là p1, e1, n1 - Có số hạt proton, electron và neutron trong Oxygen lần lượt là 8, 8, 8 - Tổng số hạt cơ bản trong phân tử M2O = 2.(p1 + e1 + n1) + 8 + 8 + 8 = 140 => p1 + e1 + n1 = 58 (1) - Tổng số hạt mang điện nhiều hơn số hạt không mang điện là 44 => (2.(p1 + e1) + 8 + 8) - (2n1 + 8) = 44 => p1 + e1 - n1 = 18 (2) - Có p1 = e1 (3) => Từ (1), (2), (3) giải hệ ba phương trình ba ẩn ta có p1 = e1 = 19, n2 = 20 => M là nguyên tố potassium (kí hiệu là K) => Vậy công thức phân tử của M2O là K2O 3.15 Hợp chất XY2, phổ biến trong sử dụng để làm cơ chế đánh lửa bằng bánh xe trong các dạng súng cổ. Mỗi phần tử XY2, có tổng các hạt proton, neutron, electron bằng 178 trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 54, số hạt mang điện của X ít hơn số hạt mang điện của Y là 12. Hãy xác định kí hiệu hóa học của X, Y. Phương pháp giải: Dựa vào mối liên hệ giữa các hạt proton (p), neutron (n) và electron (e) trong nguyên tử: - Tổng số hạt trong nguyên tử = p + n + e - Trong nguyên tử trung hòa về điện có p = e - Số hạt không mang điện = n - Proton mang điện tích dương, electron mang điện tích âm Lời giải chi tiết: - Gọi số hạt proton, electron và neutron trong nguyên tử X lần lượt là p1, e1, n1 - Có số hạt proton, electron và neutron trong Y lần lượt là p2, e2, n2 - Tổng số hạt cơ bản trong phân tử XY2 = p1 + e1 + n1 + 2.(p2 + e2 + n2)= 178 (1) - Tổng số hạt mang điện nhiều hơn số hạt không mang điện là 54 => (p1 + e1 + 2.(p2 + e2)) - (n1 + 2.n2) = 54 (2) => Từ (1), (2) giải hệ hai phương trình hai ẩn ((p1 + e1) + 2.(p2 + e2)) và (n1 + 2.n2) ta có (n1 + 2.n2) = 62, ((p1 + e1) + 2.(p2 + e2)) = 116 (3) - Số hạt mang điện của X ít hơn số hạt mang điện của Y là 12 => 2.(p2 + e2) - (p1 + e1) = 12 (4) - Có p1 = e1 (5) - Có p2 = e2 (6) => Từ (3), (4), (5), (6) giải hệ bốn phương trình bốn ẩn ta có p1 = e1 = 26 = Z1 và p2 = e2 = 16 = Z2 => X là nguyên tố iron (kí hiệu là Fe), Y là nguyên tố sulfur (kí hiệu là S)
|