Đề thi giữa kì 2 Hóa 10 - Chân trời sáng tạo - Đề số 4Tổng hợp đề thi giữa kì 2 lớp 10 tất cả các môn - Chân trời sáng tạo Toán - Văn - Anh - Lí - Hóa - Sinh Cho hai phương trình nhiệt hóa học sau:Đề bài I. Trắc nghiệm Câu 1 : Cho quá trình
Câu 2 : Cho hai phương trình nhiệt hóa học sau:
Trong hai phản ứng trên, phản ứng nào là thu nhiệt, phản ứng nào là tỏa nhiệt?
Câu 3 : Phản ứng nào sau đây không phải là phản ứng oxi hóa – khử?
Câu 4 : Phản ứng (quá trình) nào sau đây là phản ứng (quá trình) thu nhiệt?
Câu 5 : Nhiệt độ thường được chọn ở điều kiện chuẩn là ?
Câu 6 : Trong phản ứng Cl2 + Ca(OH)2\( \to \) CaOCl2 + H2O. Khẳng định nào sau đây về Chlorine là đúng
Câu 7 : Enthalpy tạo thành chuẩn (nhiệt tạo thành chuẩn) có kí hiệu là :
Câu 8 : Chất oxy hoá còn gọi là chất
Câu 9 : Trong phản ứng thu nhiệt, sự so sánh nào sau đây đúng về \(\sum {{\Delta _f}H_{298}^0(c{\rm{d}})} \)và \(\sum {{\Delta _f}H_{298}^0(sp)} \)
Câu 10 : Số oxi hóa của nguyên tử S trong hợp chất SO2 là
Câu 11 : Khi tham gia các phản ứng đốt cháy nhiên liệu, oxygen đóng vai trò là
Câu 13 : Cho phản ứng hóa học: Fe + CuSO4 → FeSO4 + Cu. Trong phản ứng trên xảy ra
Câu 15 : Cho các phát biểu sau : (1) Phản ứng phân huỷ Fe(OH)3(s) không cần cung cấp nhiệt độ liên tục. (2) Số oxi hóa của hydrogen trong các hydride kim loại bằng +1. (3) Trộn potassium chloride (KCl) vào nước là quá trình thu nhiệt. (4) Phản ứng của Fe(OH)2 với dung dịch HNO3 loãng không có sự thay đổi số oxi hóa của Fe. (5) Để giữ ấm cơ thể, trước khi lặn, người ta thường uống nước mắm cốt. Số phát biểu đúng là
Câu 16 : Trong các chất sau, chất nào bền nhất về nhiệt ở điều kiện chuẩn ? Biết nhiệt tạo thành chuẩn của HCl(g) bằng -92,31 kJ.mol-1.
II. Tự luận Lời giải và đáp án I. Trắc nghiệm Câu 1 : Cho quá trình
Đáp án : A Phương pháp giải : Dựa vào khái niệm chất khử, chất oxi hóa Lời giải chi tiết :
Cu nhường 2 electron => Cu là chất khử có quá trình oxi hóa Đáp án A Câu 2 : Cho hai phương trình nhiệt hóa học sau:
Trong hai phản ứng trên, phản ứng nào là thu nhiệt, phản ứng nào là tỏa nhiệt?
Đáp án : D Phương pháp giải : Dựa vào dấu của \(\Delta H\) Lời giải chi tiết : (1) có \(\Delta H\)> 0 => phản ứng thu nhiệt (2) có \(\Delta H\)< 0 => phản ứng tỏa nhiệt Đáp án D Câu 3 : Phản ứng nào sau đây không phải là phản ứng oxi hóa – khử?
Đáp án : B Phương pháp giải : Dựa vào sự thay đổi số oxi hóa của các chất Lời giải chi tiết : NaHCO3 → Na2CO3 + CO2 + H2O chỉ có sự giảm xuống số oxi hóa của C Đáp án B Câu 4 : Phản ứng (quá trình) nào sau đây là phản ứng (quá trình) thu nhiệt?
Đáp án : D Phương pháp giải : Dựa vào khái niệm của phản ứng thu nhiệt, tỏa nhiệt Lời giải chi tiết : Hòa tan KBr vào nước làm cho nước trở nên lạnh hơn là phản ứng thu nhiệt Đáp án D Câu 5 : Nhiệt độ thường được chọn ở điều kiện chuẩn là ?
Đáp án : B Phương pháp giải : Dựa vào điều kiện của phản ứng Lời giải chi tiết : Nhiệt độ thường được chọn là điều kiện chuẩn là 298K tương đương 25oC Đáp án B Câu 6 : Trong phản ứng Cl2 + Ca(OH)2\( \to \) CaOCl2 + H2O. Khẳng định nào sau đây về Chlorine là đúng
Đáp án : C Phương pháp giải : Dựa vào sự thay đổi số oxi hóa của chất Lời giải chi tiết : Cl2 vừa tăng vừa giảm số oxi hóa => chlorine đóng vai trò là chất oxi hóa – khử Đáp án C Câu 7 : Enthalpy tạo thành chuẩn (nhiệt tạo thành chuẩn) có kí hiệu là :
Đáp án : B Phương pháp giải : Enthalpy tạo thành chuẩn có kí hiệu \({\Delta _f}H_{298}^0\) Lời giải chi tiết : Đáp án B Câu 8 : Chất oxy hoá còn gọi là chất
Đáp án : A Phương pháp giải : Chất oxy hóa là chất nhận electron Lời giải chi tiết : Chất oxy hóa được gọi là chất bị khử Đáp án A Câu 9 : Trong phản ứng thu nhiệt, sự so sánh nào sau đây đúng về \(\sum {{\Delta _f}H_{298}^0(c{\rm{d}})} \)và \(\sum {{\Delta _f}H_{298}^0(sp)} \)
Đáp án : D Phương pháp giải : Dựa vào dấu của phản ứng thu nhiệt Lời giải chi tiết : Phản ứng thu nhiệt có \({\Delta _r}H_{298}^0\)= \(\sum {{\Delta _f}H_{298}^0(sp)} \)- \(\sum {{\Delta _f}H_{298}^0(c{\rm{d}})} \)> 0 => \(\sum {{\Delta _f}H_{298}^0(sp)} \)>\(\sum {{\Delta _f}H_{298}^0(c{\rm{d}})} \) Đáp án D Câu 10 : Số oxi hóa của nguyên tử S trong hợp chất SO2 là
Đáp án : B Phương pháp giải : Dựa vào quy tắc xác định số oxi hóa của nguyên tử Lời giải chi tiết : Số oxi hóa của S trong SO2 là +4 Đáp án B Câu 11 : Khi tham gia các phản ứng đốt cháy nhiên liệu, oxygen đóng vai trò là
Đáp án : B Phương pháp giải : Dựa vào số oxi hóa của oxygen Lời giải chi tiết : Oxygen đóng vai trò là chất oxi hóa Đáp án B
Đáp án : B Phương pháp giải : Dựa vào khái niệm của phản ứng tỏa nhiệt, phản ứng thu nhiệt Lời giải chi tiết : a) Trong phản ứng thu nhiệt, dấu của \(\Delta H\)dương vì năng lượng của hệ chất phản ứng nhỏ hơn năng lượng của hệ sản phẩm b) Trong phản ứng tỏa nhiệt có sự giải phóng năng lượng c) Trong phản ứng tỏa nhiệt, \(\Delta H\)có dấu âm vì năng lượng của hệ chất phản ứng lớn hơn năng lượng của hệ chất sản phẩm d) Trong phản ứng thu nhiệt có sự hấp thụ năng lượng Đáp án B Câu 13 : Cho phản ứng hóa học: Fe + CuSO4 → FeSO4 + Cu. Trong phản ứng trên xảy ra
Đáp án : D Phương pháp giải : Dựa vào sự thay đổi số oxi hóa của các chất Lời giải chi tiết : Trong phản ứng trên xảy ra sự oxi hóa Fe và sự khử Cu2+ Đáp án D
Đáp án : B Phương pháp giải : Dựa vào \({\Delta _r}H_{298}^0\) (1) Lời giải chi tiết : Khi lấy gấp 3 lần khối lượng của các chất phản ứng thì \({\Delta _r}H_{298}^0\) = 3. -285,66 = -856,98 kJ Đáp án B Câu 15 : Cho các phát biểu sau : (1) Phản ứng phân huỷ Fe(OH)3(s) không cần cung cấp nhiệt độ liên tục. (2) Số oxi hóa của hydrogen trong các hydride kim loại bằng +1. (3) Trộn potassium chloride (KCl) vào nước là quá trình thu nhiệt. (4) Phản ứng của Fe(OH)2 với dung dịch HNO3 loãng không có sự thay đổi số oxi hóa của Fe. (5) Để giữ ấm cơ thể, trước khi lặn, người ta thường uống nước mắm cốt. Số phát biểu đúng là
Đáp án : A Phương pháp giải : Dựa vào quá trình thu nhiệt, tỏa nhiệt Lời giải chi tiết : (1) sai vì cần cung cấp nhiệt độ liên tục (2) sai, số oxi hóa của hydrogen trong hydride kim loại bằng -1 (3) đúng (4) sai, Fe+2 tăng số oxi hóa (5) đúng Câu 16 : Trong các chất sau, chất nào bền nhất về nhiệt ở điều kiện chuẩn ? Biết nhiệt tạo thành chuẩn của HCl(g) bằng -92,31 kJ.mol-1.
Đáp án : D Lời giải chi tiết : HCl(g) bền nhất ở điều kiện chuẩn Đáp án D II. Tự luận Lời giải chi tiết : a) Nhiệt lượng cần để đun sôi 30kg nước là: Q = m.C.T = 30 . 4200 . 80 = 10080000J = 10080 kJ b) Cần cung cấp số kJ nhiệt từ đốt gas là: (10080 : 50400) : 80% = 0,25 kg Lời giải chi tiết : n khí = 9,916 : 24,79 = 0,4 mol Gọi số mol NO và NO2 lần lượt là x và y Ta có: x + y = 0,4 mol (1) M khí = 19.2 = 38 => m khí = 38 . 0,4 = 15,2g => 30x + 46y = 15,2 (2) Từ (1) và (2) ta có: x = y = 0,2 mol Theo bảo toàn electron: 2n Cu = 3. n NO + n NO2 => n Cu = 0,4 mol => m Cu = 0,4 . 64 = 25,6g
|













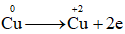 , đây là quá trình
, đây là quá trình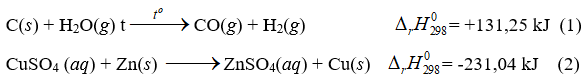

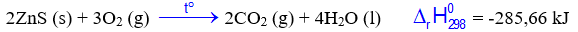
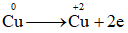 :
: