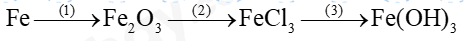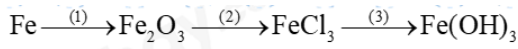Đề thi giữa kì 1 KHTN 8 Cánh diều - Đề số 2Tải về Câu 1: Công dụng của bình thủy tinh có nút nhám là A. đo khối lượng. B. đo thể tích. C. bảo quản hóa chất. D. đun nóng. Tổng hợp đề thi giữa kì 2 lớp 8 tất cả các môn - Cánh diều Toán - Văn - Anh - Khoa học tự nhiên Lựa chọn câu để xem lời giải nhanh hơn Đề thi I. Trắc nghiệm ( 7,5 điểm) Câu 1: Công dụng của bình thủy tinh có nút nhám là A. đo khối lượng. B. đo thể tích. C. bảo quản hóa chất. D. đun nóng. Câu 2: Trong các quá trình sau, quá trình nào xảy ra biến đổi vật lí? A. Đường cháy thành than. B. Cơm để lâu bị ôi thiu. C. Sữa chua lên men. D. Nước hóa rắn ở 0oC. Câu 3: Sản phẩm của phản ứng: Sắt (iron) + hydrochloric acid → iron (II) chloride + hydrogen là A. sắt (iron). B. hydrochloric acid. C. iron (II) chloride. D. iron (II) chloride và hydrogen. Câu 4: Những loại phản ứng nào sau đây cần phải cung cấp năng lượng trong quá trình phản ứng? A. Phản ứng đốt cháy cồn. B. Phản ứng quang hợp. C. Phản ứng đốt cháy xăng. D. Phản ứng đốt cháy que diêm Câu 5: Số mol của 50g CaCO3 là: A. 2 B. 1 C. 0,5 D. 1,5 Câu 6: Biết phần trăm khối lượng đường trong 120g cốc nước đường là 1,8%. Khối lượng đường trong cốc nước đường là: A. 1,8g B. 2,16g C. 12g D. 18g Câu 7: Khối lượng của CuSO4 có trong 100ml dung dịch CuSO4 0,5 M là A. 80 gam B. 160 gam C. 16 gam. D. 8 gam. Câu 8: Cho 4,8 gam Mg tác dụng với dung dịch chứa 3,65 gam hydrochloride acid(HCl) thu được magnesium chloride (MgCl2) và khí hydrogen. Thể tích khí H2 thu được ở dktc là A. 2,2400 lít. B. 2,4790 lít. C. 1,2395 lít. D. 4,5980 lít. Câu 9: Những phát biểu nào dưới đây là đúng? (a) Khi đốt củi, nếu thêm một ít dầu hỏa, lửa sẽ cháy mạnh hơn. Như vậy, dầu hỏa là chất xúc tác cho quá trình này. (b) Trong quá trình sản xuất rượu (ethylic alcohol) từ gạo, người rắc men gạo đã nấu chín (cơm) trước khi ủ vì men là chất xúc tác có tác dụng làm tăng tốc độ phản ứng chuyển hóa tinh bột thành rượu. (c) Một chất xúc tác có thể là chất xúc tác cho tất cả phản ứng. (d) Có thể dùng chất ức chế để làm giảm tốc độ của phản ứng. A. 1 B. 2 C. 3 D. 4 Câu 10: Dãy dung dịch/chất lỏng nào sau đây làm đổi màu quỳ tím thành đỏ? A. HNO3, H2O, H3PO4. B. CH3COOH, HCl, HNO3. C. HBr, H2SO4, H2O. D. HCl, NaCl, KCl. Câu 11: Dãy chất nào sau đây chỉ gồm các base tan? A. Ba(OH)2, NaOH, KOH. B. NaOH, Mg(OH)2, KOH. C. NaOH, KOH, Cu(OH)2. D. Mg(OH)2, Cu(OH)2, KOH. Câu 12: Chất nào sau đây tác dụng được với dung dịch NaOH? A. Na2O. B. CaO. C. SO2. D. Fe2O3. Câu 13: Phản ứng nào sau đây không tạo ra muối? A. Acid tác dụng với base. B. Kim loại tác dụng với oxygen. C. Acid tác dụng với oxide base. D. Base tác dụng với oxide acid. Câu 14: Dung dịch X có pH = 3,0; dung dịch Y có pH = 9,0. Kết luận nào sau đây về dung dịch X và Y là đúng? A. Cả X và Y đều là dung dịch acid. B. Cả X và Y đều là dung dịch base. C. X là dung dịch acis, Y là dung dịch base. D. X là dung dịch base, Y là dung dịch acid Câu 15: Công thức hóa học của một trong các loại phân đạm là A. KCl. B. NaCl. C. MgSO4. D. NH4NO3 II. Tự luận (2,5 điểm) Câu 1: Hoàn thành dãy chuyển hóa sau Câu 2: Cho một chiếc đinh sắt vào 20 ml dung dịch CuSO4 0,1 m. Sau phản ứng kết thúc, thấy có kim loại màu đỏ được tạo thành. a) Viết phương trình hóa học của phản ứng xảy ra b) Giả sử CuSO4 trong dung dịch phản ứng hết, tính khối lượng kim loại màu đỏ được tạo ra Đáp án Phần trắc nghiệm
Câu 1: Công dụng của bình thủy tinh có nút nhám là A. đo khối lượng. B. đo thể tích. C. bảo quản hóa chất. D. đun nóng. Phương pháp giải Bình thủy tinh có nút nhám dùng để bảo quản hóa chất Lời giải chi tiết Đáp án C Câu 2: Trong các quá trình sau, quá trình nào xảy ra biến đổi vật lí? A. Đường cháy thành than. B. Cơm để lâu bị ôi thiu. C. Sữa chua lên men. D. Nước hóa rắn ở 0oC. Phương pháp giải Biến đổi vật lí là quá trình chất thay đổi trạng thái, kích thước,… nhưng không đổi về chất Lời giải chi tiết Đáp án D Câu 3: Sản phẩm của phản ứng: Sắt (iron) + hydrochloric acid → iron (II) chloride + hydrogen là A. sắt (iron). B. hydrochloric acid. C. iron (II) chloride. D. iron (II) chloride và hydrogen. Phương pháp giải Sản phẩm là chất được tạo thành sau phản ứng Lời giải chi tiết Đáp án D Câu 4: Những loại phản ứng nào sau đây cần phải cung cấp năng lượng trong quá trình phản ứng? A. Phản ứng đốt cháy cồn. B. Phản ứng quang hợp. C. Phản ứng đốt cháy xăng. D. Phản ứng đốt cháy que diêm Phương pháp giải Phản ứng cần phải cung cấp năng lượng là phản ứng thu nhiệt Lời giải chi tiết Đáp án B Câu 5: Số mol của 50g CaCO3 là: A. 2 B. 1 C. 0,5 D. 1,5 Phương pháp giải Dựa vào công thức: n = m : M Lời giải chi tiết n CaCO3 = 50 : 100 = 0,5 mol Đáp án C Câu 6: Biết phần trăm khối lượng đường trong 120g cốc nước đường là 1,8%. Khối lượng đường trong cốc nước đường là: A. 1,8g B. 2,16g C. 12g D. 18g Phương pháp giải Dựa vào % khối lượng của đường trong cốc nước đường Lời giải chi tiết Khối lượng đường = 120. 1,8% = 2,16g Đáp án B Câu 7: Khối lượng của CuSO4 có trong 100ml dung dịch CuSO4 0,5 M là A. 80 gam B. 160 gam C. 16 gam. D. 8 gam. Phương pháp giải Dựa vào công thức tính CM để tính số mol của CuSO4 Lời giải chi tiết CM = n : V => n CuSO4 = 0,5.0,1 = 0,05 mol => m CuSO4 = 0,05 . 160 = 8g Đáp án D Câu 8: Cho 4,8 gam Mg tác dụng với dung dịch chứa 3,65 gam hydrochloride acid(HCl) thu được magnesium chloride (MgCl2) và khí hydrogen. Thể tích khí H2 thu được ở dktc là A. 2,2400 lít. B. 2,4790 lít. C. 1,2395 lít. D. 4,5980 lít. Phương pháp giải Viết phương trình hóa học, tính chất hết chất dư Lời giải chi tiết \(\begin{array}{l}{n_{Mg}} = \frac{{4,8}}{{48}} = 0,1mol;{n_{HCl}} = \frac{{3,65}}{{36,5}} = 0,1mol\\Mg + 2HCl \to MgC{l_2} + {H_2}\end{array}\) Dựa vào tỉ lệ phản ứng n HCl < n Mg => HCl hết n H2 = 0,1 : 2 = 0,05 mol V = 0,05 . 24,79 = 1,2395 lít Đáp án C Câu 9: Những phát biểu nào dưới đây là đúng? (a) Khi đốt củi, nếu thêm một ít dầu hỏa, lửa sẽ cháy mạnh hơn. Như vậy, dầu hỏa là chất xúc tác cho quá trình này. (b) Trong quá trình sản xuất rượu (ethylic alcohol) từ gạo, người rắc men gạo đã nấu chín (cơm) trước khi ủ vì men là chất xúc tác có tác dụng làm tăng tốc độ phản ứng chuyển hóa tinh bột thành rượu. (c) Một chất xúc tác có thể là chất xúc tác cho tất cả phản ứng. (d) Có thể dùng chất ức chế để làm giảm tốc độ của phản ứng. A. 1 B. 2 C. 3 D. 4 Lời giải chi tiết (a) sai vì dầu hỏa cháy và mất đi sau phản ứng (b) đúng (c) sai (d) đúng Đáp án B Câu 10: Dãy dung dịch/chất lỏng nào sau đây làm đổi màu quỳ tím thành đỏ? A. HNO3, H2O, H3PO4. B. CH3COOH, HCl, HNO3. C. HBr, H2SO4, H2O. D. HCl, NaCl, KCl. Phương pháp giải Dung dịch làm đổi màu quỳ tím thành đỏ là dung dịch acid Lời giải chi tiết Đáp án B Câu 11: Dãy chất nào sau đây chỉ gồm các base tan? A. Ba(OH)2, NaOH, KOH. B. NaOH, Mg(OH)2, KOH. C. NaOH, KOH, Cu(OH)2. D. Mg(OH)2, Cu(OH)2, KOH. Phương pháp giải Base tan là base của gốc kim loại: K, NA, Ca, Ba, Li Lời giải chi tiết Đáp án A Câu 12: Chất nào sau đây tác dụng được với dung dịch NaOH? A. Na2O. B. CaO. C. SO2. D. Fe2O3. Phương pháp giải Oxide tác dụng với dung dịch base là oxide acid Lời giải chi tiết Đáp án C Câu 13: Phản ứng nào sau đây không tạo ra muối? A. Acid tác dụng với base. B. Kim loại tác dụng với oxygen. C. Acid tác dụng với oxide base. D. Base tác dụng với oxide acid. Lời giải chi tiết Đáp án B vì kim loại tác dụng với oxygen tạo oxide Câu 14: Dung dịch X có pH = 3,0; dung dịch Y có pH = 9,0. Kết luận nào sau đây về dung dịch X và Y là đúng? A. Cả X và Y đều là dung dịch acid. B. Cả X và Y đều là dung dịch base. C. X là dung dịch acid, Y là dung dịch base. D. X là dung dịch base, Y là dung dịch acid Phương pháp giải Dung dịch có pH = 3 có môi trường acid, dung dịch có pH = 9 có môi trường base Lời giải chi tiết Đáp án C Câu 15: Công thức hóa học của một trong các loại phân đạm là A. KCl. B. NaCl. C. MgSO4. D. NH4NO3 Lời giải chi tiết Đáp án D II. Tự luận Câu 1: Hoàn thành dãy chuyển hóa sau Lời giải chi tiết \(\begin{array}{l}(1)4Fe + 3{O_2} \to 2F{e_2}{O_3}\\(2)F{e_2}{O_3} + 6HCl \to 2FeC{l_3} + 3{H_2}O\\(3)FeC{l_3} + 3NaOH \to Fe{(OH)_3} + 3NaCl\end{array}\) Câu 2: Cho một chiếc đinh sắt vào 20 ml dung dịch CuSO4 0,1M. Sau phản ứng kết thúc, thấy có kim loại màu đỏ được tạo thành. a) Viết phương trình hóa học của phản ứng xảy ra b) Giả sử CuSO4 trong dung dịch phản ứng hết, tính khối lượng kim loại màu đỏ được tạo ra. Phương pháp giải: Dựa vào tính chất hóa học của muối Lời giải chi tiết: nCuSO4 = CM x V = 0,1 x 20 x 10−3 = 2 x10−3 (mol) a) PTHH: Fe + CuSO4 → FeSO4 + Cu b) nCuSO4 = CM x V = 0,1 x 20 x 10−3 = 2 x10−3 (mol) Theo PTHH: nCuSO4 = nCu => mCu = 2 x 10−3 x 64 = 0,128 (gam).
|