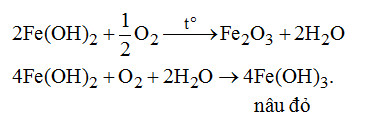Đề kiểm tra 15 phút – Đề số 2 – Chương 7 – Hóa học 12Đáp án và lời giải chi tiết đề thi kiểm tra 15 phút – Đề số 2 – Chương 7 – Hóa học 12 Đề bài Câu 1.Dãy gồm những hợp chất nào sau đây của sắt có tính khử và tính oxi hóa (chỉ xét nguyên tô Fe)? \(\begin{array}{l}A.\,FeO.\\C.\,F{e_2}{O_3},FeC{l_2}.\end{array}\) \(\begin{array}{l}B.\,FeC{l_3},Fe{(OH)_3}.\\D.\,FeS{O_4},F{e_2}{(S{O_4})_3}\end{array}\) Câu 2. Nguyên tố Fe không thay đổi số oxi hóa khi cho \(F{e_3}{O_4}\) phản ứng vơi chất nào sau đây? \(\begin{array}{l}A.\,{H_2}.\\C.\,HCl.\end{array}\) \(\begin{array}{l}B.\,HN{O_3}.\\D.\,C\,(cacbon).\end{array}\) Câu 3. Chất X thỏa mãn điều kiện sau: + X tác dụng với \({O_2}\) trong điều kiện thích hợp thu được \(F{e_2}{O_3}\) + X để lâu trong không khí ẩm bị chuyển nâu đỏ + X nung nóng bị giảm khối lượng. X là chất nào trong các chất sau đây? A. Fe. B. FeO. C. \(Fe{(OH)_2}.\) D. \(Fe{(N{O_3})_2}.\) Câu 4. Biết thứ tự dãy điện hóa: \(F{e^{2 + }}/Fe < 2{H^ + }/{H_2} < C{u^{2 + }}/Cu < F{e^{3 + }}/F{e^{2 + }}\). Phản ứng nào sai trong số các phản ứng sau đây? \(\begin{array}{l}A.\,Fe + 2F{e^{3 + }} \to 3F{e^{2 + }}.\\B.\,F{e^{2 + }} + 2{H^ + } \to F{e^{3 + }} + {H_2}.\\C.\,Fe + C{u^{2 + }} \to F{e^{2 + }} + Cu.\\ D.\,Cu + 2F{e^{3 + }} \to C{u^{2 + }} + 2F{e^{2 + }}.\end{array}\) Câu 5. Dung dịch X chứa \(FeC{l_2}\) và \(FeC{l_3}\). Để chuyển dung dịch X thành dung dịch \(FeC{l_3}\) cần cho X tác dụng với A. Cu dư. B. Al dư. C. \(C{l_2}\) dư. D. Fe dư. Câu 6. Phản úng nào dưới đây không sinh ra FeO? Câu 7. Hóa chất duy nhất để phân biệt trực tiếp hỗn hợp \(\left( {Fe + FeO} \right)\,;(FeO + F{e_2}{O_3});\)\(\,(Fe + F{e_2}{O_3})\) là A. dung dịch HCl dư. B. dung dịch \(HN{O_3}\) loãng dư. C. khi \(CO/t^\circ \) D. dung dịch \(CuS{O_4}.\) Câu 8. Cho dung dịch \(FeC{l_2},ZnC{l_2}\) tác dụng với dung dịch NaOH dư. Lọc lấy kết tủa, nung trong không khí đến khối lượng không đổi, chất rắn thu được là \(\begin{array}{l}A.\,FeO,ZnO.\\B.\,F{e_2}{O_3},ZnO.\\C.\,F{e_2}{O_3}\\D.\,FeO.\end{array}\) Câu 9. Cho 2,4 gam Mg vào 200 ml dung dịch \(FeC{l_3}\) 0,4M. Các phản ứng nào sau đây xảy ra? \(\begin{array}{l}2FeC{l_3} + Mg \to MgC{l_2} + FeC{l_2}\,\,(1)\\3Mg + 2FeC{l_2} \to 3MgC{l_2} + 2Fe\,\,\,(2)\\Mg + FeC{l_2} \to MgC{l_2} + Fe\,\,\,\,(3)\\2FeC{l_3} + Fe \to 3FeC{l_2}\,\,\,\,(4)\end{array}\) A. (1) và (3). B. (2) và (4). C. (1) và (2). D. (1). Câu 10. Hòa tan hỗn hơp gồm 0,2 mol Fe và 0,1 mol \(F{e_2}{O_3}\) vào dung dịch HCl dư, được dung dịch. Cho dung dịch A tác dụng với NaOH dư, thu được kết tủa. Lọc kết tủa, rửa sạch, sấy khô, nung trong không khí đến khối lượng không đổi thu được m gam chất rắn. Giá trị của m là A. 16 gam. B. 30,4 gam. C. 32 gam. D. 48 gam. Lời giải chi tiết Câu 1. Chọn A. Số oxi hóa của Fe gồm: 0, +2, +3. Số oxi hóa +2 (trung gian) là điều kiện cần để có cả tính khử và tính oxi hóa. Câu 2. Chọn C. \(F{e_3}{O_4} + 8HCl \to FeC{l_2} + FeC{l_3} + 4{H_2}O\) (\(F{e_3}{O_4}\) tương tự hỗn hợp \(FeO.F{e_2}{O_3}\) chứa cả \(F{e^{2 + }}\) và \(F{e^{3 + }}\)). Câu 3. Chọn C.
Câu 4. Chọn B. Câu 5. Chọn C. \(2FeC{l_2} + C{l_2} \to 2FeC{l_3}.\) Câu 6. Chọn C.
Câu 7. Chọn A. \(Fe,FeO \to FeC{l_2}\) (xanh nhạt) \( + {H_2}\) (bọt khí) \(FeO,F{e_2}{O_3} \to FeC{l_2} + FeC{l_3}\) (vàng nâu) \(Fe,F{e_2}{O_3} \to FeC{l_2} + FeC{l_3}\) (vàng nâu) \( + {H_2}\) (bọt khí). Câu 8. Chọn C. \(\begin{array}{l}FeC{l_2} \to Fe{(OH)_2} \to F{e_2}{O_3}\\ZnC{l_2} \to Zn{(OH)_2} \to N{a_2}Zn{O_2}\end{array}\) Câu 9. Chọn A. Phản ứng (1) xảy ra trước, sau phản ứng (1) còn dư Mg, xảy ra tiếp phản ứng (3). Câu 10. Chọn C. Vì số mol nguyên tử Fe không đổi nên \({n_{Fe}} + 2{n_{F{e_2}{O_3}(bd)}} = 2{n_{F{e_2}{O_3}(thu)}} = 0,4\,mol.\) \(\eqalign{ xemloigiai.com
|