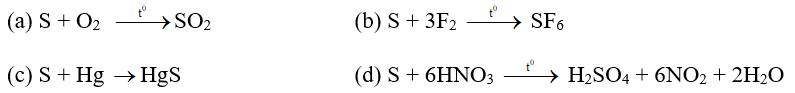Cho enthalpy tạo thành chuẩn của một số chất như sau:

Biến thiên enthalpy chuẩn của phản ứng:
\(TiC{l_4}(g) + 2{H_2}O(l) \to Ti{O_2}(s) + 4HCl(g)\)
- A.
22 kJ
- B.
3 kJ
- C.
-22 kJ
- D.
-3229 J
Đáp án : A
Dựa vào công thức tính \({\Delta _r}H_{298}^0\)
\({\Delta _r}H_{298}^0\)= \({\Delta _f}H_{298}^0(Ti{O_2}) + 4.{\Delta _f}H_{298}^0(HCl) - {\Delta _f}H_{298}^0(TiC{l_4}) - 2{\Delta _f}H_{298}^0({H_2}{\rm{O}})\)
= -945 + 4. (-92) – 2.(-286) – (-763) = 22 KJ
Đáp án A
Các bài tập cùng chuyên đề
Trong các chất: FeCl2, FeCl3, Fe(NO3)2, Fe(NO3)3, FeSO4, Fe2(SO4)3. Số chất có cả tính oxi hoá và tính khử là
Cho các phản ứng:
Ca(OH)2 + Cl2→ CaOCl2 + H2O 2H2S + SO2→ 3S + 2H2O
2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O 4KClO3 → KCl + 3KClO4
O3→ O2 + O
Số phản ứng oxi hoá - khử là
Tỉ lệ hệ số chất khử và chất oxi hóa trong phản ứng là:
FeO + HNO3(đặc) \( \to \) Fe(NO3)3 + NO2 + H2O
Cho 2,8 gam hỗn hợp X gồm Cu và Ag phản ứng hoàn toàn với dung dịch HNO3 dư, thu được 0,04 mol NO2 (sản phẩm khử duy nhất) và dung dịch chứa m gam muối. Giá trị của m là
Nhiệt tạo thành chuẩn của một chất là nhiệt lượng tạo thành 1 mol chất đó từ chất nào ở điều kiện chuẩn?
Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:
\({N_2}(g) + {O_2}(g) \to 2NO(g){\rm{ }}\Delta rH_{298}^0 = 180kJ\)
Kết luận nào sau đây đúng?
Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)?
Dựa vào phương trình nhiệt hóa học của phản ứng sau:
\(C{O_2}(g) \to CO(g) + \frac{1}{2}{O_2}(g){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = 280kJ\)
Giá trị \({\Delta _r}H_{298}^0\)của phản ứng: \(2C{O_2}(g) \to 2CO(g) + {O_2}(g)\)là: