Acetylene là một hydrocarbon được dùng làm nhiên liệu trong đèn xì oxy-acetylene (khi tác dụng với oxygen) để hàn hay cắt kim loại. Kết quả phân tích nguyên tố của acetylene có 7,69% H về khối lượng. Phân tử khối của acetylene gấp 13 lần phân tử khối của hydrogen. Công thức phân tử của acetylene
- A. C2H4
- B. C2H6
- C. C2H2
- D. C2H8
Đáp án : C
Thiết lập công thức phân tử hợp chất hữu cơ (CxHyOzNt) từ dữ liệu phân tích nguyên tố và phân tử khối (M) được khái quát như sau:
\({\rm{x = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{C}}}}}{{{\rm{12}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{; y = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{H}}}}}{{\rm{1}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{; z = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{O}}}}}{{{\rm{16}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{; t = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{N}}}}}{{{\rm{14}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}\)
Với x, y, z, t lần lượt là số nguyên tử C, số nguyên tử H, số nguyên tử O, số nguyên tử N; %mC, %mH, %mO, %mN lần lượt là % khối lượng của các nguyên tố C, H, O, N trong hợp chất hữu cơ.
Gọi công thức phân tử của acetylene là CxHy.
Ta có: %mH = 7,69% => %mC = 100% - 7,69% = 92,31%
Vì phân tử khối của acetylene gấp 13 lần phân tử khối của hydrogen nên \({{\rm{M}}_{{\rm{Acetylene}}}} = {\rm{ }}13{{\rm{M}}_{{{\rm{H}}_{\rm{2}}}}} = 13 \times 2 = 26\)
\(\begin{array}{l}{\rm{x = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{C}}}}}{{{\rm{12}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{ = }}\frac{{92,31}}{{{\rm{12}}}} \times \frac{{26}}{{{\rm{100}}}} \approx 2\\{\rm{y = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{H}}}}}{{\rm{1}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{ = }}\frac{{7,69}}{{\rm{1}}} \times \frac{{26}}{{{\rm{100}}}} \approx 2\end{array}\)
Vậy công thức phân tử của acetylene là C2H2
Các bài tập cùng chuyên đề
(2 điểm) Cho các ion sau phản ứng với nhau từng đôi một: Ba2+, Mg2+, NH4+, H+, OH-, CO32-, SO42-, HCO3-. Viết các phương trình phản ứng xảy ra.
(2 điểm) Cho dung dịch HCl 1 M (dung dịch A) và dung dịch NaOH 1 M (dung dịch B).
(a) Lấy 10 mL dung dịch A, thêm nước để được 100 mL. Tính pH của dung dịch sau khi pha loãng
(b) Lấy 10 mL dung dịch B, thêm nước để được 100 mL. Tính pH của dung dịch sau khi pha loãng
Khi SO2 sinh ra từ việc đốt các nhiên liệu hóa thạch, các quặng sulfide là một trong các hợp chất gây ô nhiễm môi trường, do SO2 góp phần gây ra
Cho nhiệt tạo thành chuẩn của SO2(g) và SO3(g) lần lượt là –296,8 kJ/mol và -395,7 kJ/mol.
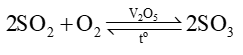
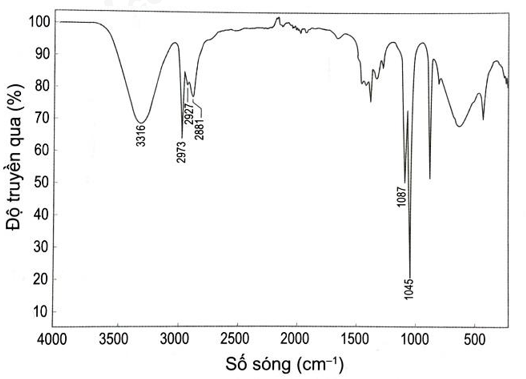
Quan sát phổ hồng ngoại (IR) của hợp chất X có công thức C2H5OH dưới đây, hãy chỉ ra peak nào giúp dự đoán X có nhóm –OH?
Khi tách và tinh chế chất lỏng dựa trên sự khác nhau về nhiệt độ sôi của các chất trong hỗn hợp ở áp suất nhất định, người ta thường sử dụng phương pháp nào sau đây?












