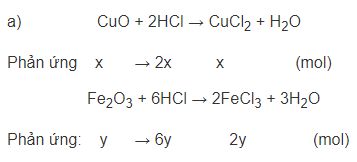Bài 3 trang 9 SGK Hóa học 9200ml dung dịch HCl Đề bài 200ml dung dịch HCl có nồng độ 3,5M hòa tan vừa hết 20 g hỗn hợp hai oxit CuO và Fe2O3 a) Viết các phương trình hóa học b) Tính khối lượng của mỗi oxit có trong hỗn hợp ban đầu. Phương pháp giải - Xem chi tiết Đổi số mol của HCl Gọi số mol của CuO và lần lượt là x, y (mol) PTHH: CuO + 2HCl → CuCl2 + H2O Phản ứng x → 2x x (mol) Fe2O3 + 6HCl → 2FeCl3 + 3H2O Phản ứng: y → 6y 2y (mol) Giải hệ 2 ẩn 2 phương trình \(\left\{ \begin{gathered} Lời giải chi tiết Số mol HCl = 3,5 . 0,2 = 0,7 mol Gọi x, y là số mol của CuO và Fe2O3
Từ phương trình phản ứng trên ta có nHCl(1) = 2nCuO = 2x mol \({n_{HCl(2)}} = 6{n_{F{{\rm{e}}_2}{O_3}}} = 6y\,\,mol\) \( \to {n_{HCl}} = 2{\rm{x}} + 6y = 0,7\,\,mol(*)\) \({m_{CuO}} = (64 + 16)x = 80{\rm{x}}\,\,{\rm{gam}}\) \({m_{F{{\rm{e}}_2}{O_3}}} = (56.2 + 16.3)y = 160y\,\,gam\) Theo bài: mhỗn hợp = \({m_{CuO}} + {m_{F{{\rm{e}}_2}{O_3}}} = 80{\rm{x}} + 160y = 20g\)(**) Từ (*) và (**) ta có hệ phương trình: \(\left\{ \begin{gathered} Vậy \({n_{CuO}} = 0,05\,mol\) và \({n_{F{e_2}{O_3}}} = 0,1\,mol\) b) \({m_{CuO}}= 0,05 . 80 = 4\, g\) \({m_{F{e_2}{O_3}}}= 20 - 4 = 16\, g\) xemloigiai.com
|